常温下,Ksp(CaSO4)=9×10-6,常温下CaSO4在水中的沉淀溶解平衡曲线见图。下列说法正确的是
| A.常温下CaSO4饱和溶液中,c(Ca2+)、c(SO42—)对应于曲线上任意一点 |
| B.b点将有沉淀生成,平衡后溶液中c(SO42—)等于3×10-3 mol·L—1 |
| C.d点溶液通过蒸发可以变到c点 |
| D.a点对应的Ksp等于c点对应的Ksp |
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH+H2===LiNH2+LiH,下列有关说法正确的是( )
| A.Li2NH中N的化合价是-1 |
| B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H-的离子半径相等 |
| D.此法储氢和钢瓶储氢的原理相同 |
一定条件下,PbO2与Cr3+反应,产物是Cr2O和Pb2+,则与1 mol Cr3+反应所需PbO2的物质的量为( )
| A.3.0 mol | B.1.5 mol |
| C.1.0 mol | D.0.75 mol |
下列溶液中的Cl-浓度与50 mL 1 mol·L-1 MgCl2溶液中的Cl-浓度相等的是( )
| A.150 mL 1 mol·L-1 NaCl溶液 |
| B.75 mL 2 mol·L-1 CaCl2溶液 |
| C.150 mL 2 mol·L-1 KCl溶液 |
| D.75 mL 1 mol·L-1 AlCl3溶液 |
体积为V mL,密度为d g/mL,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是( )
| A.m=aV/100d | B.c=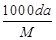 |
C.c=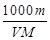 |
D.a%=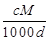 % % |
某固体仅由一种元素组成,其密度为5 g/cm3。用X射线研究该固体的结果表明:在棱长为1×10-7 cm的立方体中含有20个原子,则此元素的相对原子质量最接近( )
| A.32 | B.65 | C.120 | D.150 |