实验室既可用浓盐酸与MnO2在加热时反应制备Cl2,也可用KMnO4与浓盐酸在常温下反应制备Cl2,下列有关说法中不正确的是( )
| A.由题目信息知:KMnO4的氧化性比MnO2的强 |
| B.制备氯气的整个实验过程中,只需要使用氧化剂与还原剂 |
| C.用排气法收集不需要利用其他试剂就能确定集气瓶中已收集满气体 |
| D.用足量MnO2与含有4 mol HCl的浓盐酸在加热条件下反应,得到Cl2的物质的量小于1 mol |
下列是卤素单质(F2、Cl2、Br2、I2)的沸点与相对分子质量的关系图,下列说法错误的是( )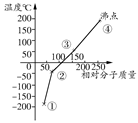
| A.单质①是最活泼的非金属单质 |
| B.单质②能使品红溶液褪色 |
| C.单质③在常温下是液态 |
| D.单质的氧化性强弱顺序是④>③>②>① |
下列实验现象与新制氯水中的某些成分(括号内物质)没有关系的是( )
| A.将NaHCO3固体加入新制氯水中,有无色气泡产生(H+) |
| B.使红色布条褪色(HCl) |
| C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2) |
| D.滴加AgNO3溶液生成白色沉淀(Cl-) |
海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)。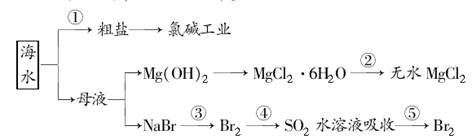
下列有关说法不正确的是( )
| A.从能量转换角度来看,框图中的氯碱工业是一个将电能转化为化学能的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
| D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3+等杂质,加入化学药品的顺序为:Na2CO3溶液―→NaOH溶液―→BaCl2溶液―→过滤后加盐酸 |
在氯水中存在着如下反应:Cl2+H2O=HCl+HClO,因此氯水中存在多种分子和离子。在下列实验现象中与相应离子或分子性质关系正确的是( )
| A.氯水有刺激性气味说明氯水中有HCl |
| B.氯水中滴入品红溶液,溶液为无色说明氯水中有Cl2 |
| C.向氯水中通入SO2气体,氯水黄绿色褪去说明Cl2发生了反应 |
| D.向氯水中加入CaCO3有气泡产生,说明有HCl和HClO |