下列说法正确的是
| A.SiO2(s)+2C(s)===Si(s)+2CO(g)只能在高温下自发进行,则该反应ΔH>0 |
| B.电镀时,镀层金属跟直流电源的负极相连 |
| C.锅炉内壁上沉积的CaSO4可先用饱和Na2CO3溶液浸泡,再将不溶物用稀盐酸溶解除去 |
| D.向100 mL纯水中滴加1 mL浓硫酸,水的离子积常数Kw减小 |
下列实验过程中产生的现象与对应的图形相符合的是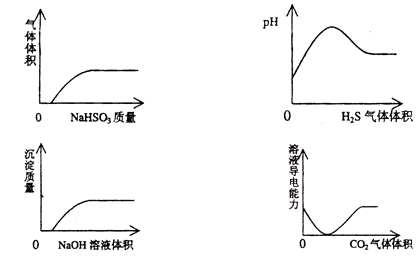
| A.NaHSO3粉末加入HNO3溶液中 |
| B.H2S气体通入氯水中 |
| C.NaOH溶液滴入Ba(HCO3)2溶液中 |
| D.CO2气体通入澄清石灰水中 |
0.001 mol 金属放入10mL 0.1 mol/L某酸溶液中, 产生22.4mL氢气(标准状况),下列情况中一定不可能的是
产生22.4mL氢气(标准状况),下列情况中一定不可能的是
| A.一价金属和一元酸 | B.二价金属和二元酸 |
| C.三价金属和二元酸 | D.二价金属和一元酸 |
下列说法正确的是
| A.101 kPa时,1 mol H2燃烧生成水蒸气放出的热量叫做H2的燃烧热 |
| B.0.25molNa2O2中含有的阴离子数约为0.25×6.02×1023 |
| C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液,反应后溶液中:c(CO32-)> c(HCO3-)> c(OH-)> c(H+) |
| D.在入海口的钢铁闸门上装一定数量的铜块可防止闸门被腐蚀 |
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1molNaAl(OH)2CO3最多可消耗3 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
根据下列化学实验事实 得出的结论一定正确的是
得出的结论一定正确的是
| A.向某无色溶液中先加入氯化钡溶液,生成白色沉淀,再加入足量盐酸,沉淀不溶解。结论:该溶液中有SO |
| B.向某无色溶液中加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝。结论:该溶液中有NH |
| C.加入过量烧碱溶液充分反应,过滤、洗涤干燥,可将铝粉中混有的少量镁粉除去。 |
| D.向1 mL 1%的NaOH溶液中加入2 mL 2%的CuSO4溶液,振荡后再加入0.5 mL有机物X,加热后未出现红色沉淀。结论:X中不含有醛基 |