氮化硅(Si3N4)是一种优良的高温结构陶瓷,在航天航空、汽车发动机、机械等领域有着广泛的用途。工业上有多种方法来制备氮化硅,常见的方法有:
(1)在1 300-l 400℃时,高纯粉状硅与纯氮气化合,其反应方程式为_________。
(2)在高温条件下利用四氯化硅气体、纯氮气、氢气反应生成氮化硅和HCl。
①已知:25℃,101 kPa条件下的热化学方程式:
3Si(s)+2N2(g)=Si3N4(s) △H= -750.2kJ/mol
Si(s)+2Cl2(g)=SiCl4(g) △H="-609.6" kJ/mol
H2(g)+Cl2(g)=2HCl(g) △H="--184.6" kJ/mol
四氯化硅气体与氮气、氢气反应的热化学方程式为____________________。
②工业上制取高纯硅和四氯化硅的生产流程如下: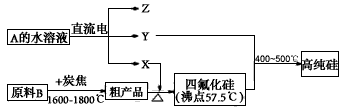
已知:X,高纯硅、原料B的主要成分都可与Z反应,Y与X在光照或点燃条件下可反应,Z的焰色呈黄色。
上述生产流程中电解A的水溶液时,阳极材料能否用Cu?________(填“能”或“不能”)。写出Cu为阳极电解A的水溶液开始一段时间阴阳极的电极方程式。阳极: ;阴极: 。
(3)由石英砂合成氮化硅粉末的路线图如下所示
(把图中的①·⑤改为I-V)
①石英砂不能与碱性物质共同存放,以NaOH为例,用化学方程式表示其原因: 。
②图示I-V的变化中,属于氧化还原反应的是 。
③SiCl4在潮湿的空气中剧烈水解,产生白雾,军事工业中用于制造烟雾剂。SiCl4水解的化学方程式为___________________。
④在反应IV中四氯化硅与氨气反应生成Si(NH2)4和一种气体 (填分子式);在反应V中Si(NH2)4受热分解,分解后的另一种产物的分子式为 。
按要求完成下列问题
(1)画出丙烯的键线式。
(2)写出乙醇和浓硫酸170℃发生脱水反应的化学方程式 ;
;
该反应类型是反应
(3) 有机物A:在
有机物A:在 较高温度下和Br2 按物质的量之比1:1发生加成反应的方程。
较高温度下和Br2 按物质的量之比1:1发生加成反应的方程。
(4)某高分子有机物 是由一种单体缩聚而成的,该单体的结构简式为。
是由一种单体缩聚而成的,该单体的结构简式为。
(5) 的一氯取代物有种,
的一氯取代物有种, 的二氯取代物有种。
的二氯取代物有种。
(6分)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液。判断:
①溶液中共有种粒子。
②溶液中有两种粒子的物质的量之和一定等于0.010mol,它们是和。
③溶液中n(CH3COO-)+n(OH-)- n(H+)=mol。
(12分)某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离: H2A H++HA-, HA-
H++HA-, HA- H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
H++A2 -已知相同浓度时的电离度α(H2A)>α(HA-),设有下列四种溶液:
A. 0.01 mol·L-1的H2A溶液
B. 0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的HCl与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液,据此,填写下列空白(填代号):
(1)c(H+)最大的是,最小的是。
(2)c(H2A)最大的是,最小的是。
(3)c(A2-)最大的是,最小的是。
(4分)氢气和氧气反应生成1mol水蒸气放热241.8KJ,已知氢气中H-H键能为436kJ/mol,氧气分子O=O键能为498 kJ/mol,则水分子中O-H键的键能为kJ/mol。若1 g水蒸气转化成液态水时放热2.5 kJ,则反应H2(g) + 1/2O2(g) ==H2O(l)的△H=kJ/mol
已知化学反应①:Fe(s)+CO2(g) FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g)
FeO(s)+CO(g),其平衡常数为K1;化学反应②:Fe(s)+H2O(g) FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
FeO(s)+H2(g),其平衡常数为K2。在温度973 K和
1173 K情况下,K1、K2的值分别如下:
| 温度 |
K1 |
K2 |
| 973 K |
1.47 |
2.38 |
| 1173 K |
2.15 |
1.67 |
(1)通过表格中的数值可以推断:反应①是(填“吸热”或“放热”)反应。
(2)现有反应③:CO2(g)+H2(g) CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=。
CO(g)+H2O(g),请你写出该反应的平衡常数K3的数学表达式:K3=。
(3)能判断反应③已达平衡状态的是。
A.容器中压强不变
B.混合气体中c(CO)不变
C.v正(H2)=v逆(H2O)
D.c(CO2)=c(CO)
(4)根据反应①与②可推导出K1、K2与K3之间的关系式。据此关系式及上表数据,也能推断出反应③是(填“吸热”或“放热”)反应。要使反应③在一定条件下建立的平衡向正反应方向移动,可采取的措施是(填写序号)。
A.缩小反应容器容积 B.扩大反应容器容积
C.降低温度 D.升高温度
E.使用合适的催化剂 F.设法减少CO的量