下列是某同学对相应的离子方程式所作的评价,其中评价合理的是
| 编号 |
化学反应 |
离子方程式 |
评 价 |
| A |
碳酸钙与 醋酸反应 |
CO32-+2CH3COOH=CO2↑+H2O+2CH3COO- |
错误,碳酸钙是弱电解 质,不应写成离子形式 |
| B |
苯酚钠溶液中 通入CO2 |
2C6H5O-+CO2+H2O→2C6H5OH+CO32- |
正确 |
| C |
NaHCO3的水解 |
HCO3-+H2O=CO32-+H3O+ |
错误,水解方程式 误写成电离方程式 |
| D |
等物质的量的FeBr2和Cl2反应 |
2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- |
错误,离子方程式中 Fe2+与Br-的物质的量 之比与化学式不符 |
某航空站安装了一台燃料电池,该电池可同时提供电和水蒸气。所用燃料为氢气,电解质为熔融的碳酸钾。已知该电池的总反应为2H2+O2=2H2O,正极反应为O2+2CO2+4e-=2CO32-,则下列推断正确的是
| A.负极反应为H2+2OH--2e-=2H2O |
| B.该电池可在常温或高温时进行工作,对环境具有较强的适应性 |
| C.该电池供应2 mol水蒸气,同时转移2 mol电子 |
| D.放电时负极有CO2生成 |
科研人员设想用右图所示装置生产硫酸,下列说法正确的是
| A.a为正极,b为负极 |
| B.负极反应式为2H2O+SO2-2e-=SO42-+4H+ |
| C.电子从b极向a极移动 |
| D.生产过程中H+向a电极区域运动 |
液体燃料电池相比于气体燃料电池具有体积小,无需气体存储装置等优点。一种以肼(N2H4)为燃料的电池装置如图所示。该电池用空气中的氧气作为氧化剂,KOH作为电解质。下列关于该燃料电池的叙述不正确的是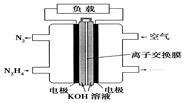
| A.电流从右侧电极经过负载后流向左侧电极 |
| B.负极发生的电极反应式为:N2H4+4OH--4e-=N2+4H2O |
| C.该燃料电池的电极材料应采用多孔导电材料,以提高电极反应物质在电极表面的吸附量,并使它们与电解质溶液充分接触 |
| D.该燃料电池持续放电时,K+从负极向正极迁移,因而离子交换膜需选用阳离子交换膜 |
将下图所示实验装置的K闭合,下列判断正确的是
| A.Cu电极上发生还原反应 |
| B.电子沿Zn→a→b→Cu路径流动 |
| C.片刻后甲池中c(SO42-)增大 |
| D.片刻后可观察到滤纸b点变红色 |
按如图所示装置进行下列不同的操作,其中不正确的是
| A.铁腐蚀的速度由大到小的顺序是:只接通K1>只闭合K3>都断开>只闭合K2 |
| B.只接通K1,一段时间后,U形管中出现白色沉淀 |
| C.只接通K2,U形管左、右两端液面均下降 |
| D.先只接通K1,一段时间后,漏斗液面上升,然后再只接通K2,漏斗液面下降 |