(16分)能源、环境与生产生活和社会发展密切相关。
(1)一定温度下,在两个容积均为2L的密闭容器中,分别发生反应:
| 容器 |
甲 |
乙 |
| 反应物投入量 |
1molCO2(g)和3molH2(g) |
1molCH3OH(g)和1molH2O(g) |
| 平衡时c(CH3OH) |
c1 |
c2 |
| 平衡时能量变化 |
放出29.4kJ |
吸收akJ |
CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
CH3OH(g)+H2O(g) △H=-49.0kJ·mol-1。相关数据如下:
①cl__________c2(填“>”、“<”或“=”),a=____________;
②该温度下反应的平衡常数K=__________;若甲中反应10s时达到平衡,则0~10s内甲中的平均反应速率v(H2)=__________。
③下列情况能说明该反应一定达到平衡状态的是________(填字母编号);
a.v(CO2)消耗=v(CH3OH)生成
b.气体的密度不再随时间改变
c.CO2和CH3OH的浓度之比不再随时间改变
d.气体的平均相对分子质量不再随时间改变
④其他条件不变,达到平衡后,下列不能提高H2转化率的操作是________(填字母编号)。
a.降低温度 b.充入更多的H2 c.移除甲醇 d.增大容器体积
(2)工业生产中H2S尾气可用NaOH溶液吸收。常温下,用a mol·L-1的NaOH溶液吸收尾气后得到的溶液中c(S2-)=c(OH-),此时溶液的pH=12,则此时溶液中的溶质为_________(填化学式),溶液中c(HS-)=__________mol·L-1(用含a的代数式表示,溶液体积变化忽略不计)。
(1)P4(s,白磷)+5O2(g)=2P2O5(s)△H=-2983.2kJ/mol
P(s,红磷)+5/4O2(g)=1/4P4O10(s)△H=-738.5kJ/mol
则相同的状况下,能量较低的是______;白磷的稳定性比红磷______(填“高”或“低”)。
(2)CH3—CH3 (g)→ CH2=CH2(g)+H2(g);有关化学键的键能如下。
化学键 C-H C=C C-C H-H
键能(kJ/mol) 414 615 347 435
试计算该反应的反应热为__________.
下表为元素周期表的一部分。请参照元素①~⑧在表中的位置,回答下列问题:
(1)④⑤⑥的原子半径由小到大的顺序为(用元素符号表示)。
②③⑦的最高价含氧酸的酸性由弱到强的顺序是(用化学式表示)。
(2)④与⑤常温下可发生反应生成化合物A,请用电子式表示A的形成过程______________。
(3)由表中元素①③④⑥⑧所形成的常见物质X、Y、Z、M、N可发生以下反应: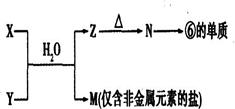
①X溶液与Y溶液反应的离子方程式为;
②由N制取⑥对应的单质所采用的方法是;
③M溶液呈酸性,原因是(用离子方程式解释)。
已知KCl、K2Cr2O7、CrCl3、Cl2、HCl在溶液中可以形成一个氧化还原反应体系。
(1)已知反应中有水生成,则反应物分别是K2Cr2O7和(填化学式),当电子转移数为6mol时,化学方程式中水的化学计量数是。
(2)反应过程中,被还原的元素是_________。
(9分)将一支盛有a mL NO和b mL NO2气体的试管倒立于水槽中,然后通入a mL O2,问:
(1)若a=b,则充分反应后试管内气体体积为__________mL。
(2)若a<b,则充分反应后试管内气体体积为__________mL。
(3)若a>b,则充分反应后试管内气体体积为__________mL。
(每空3分,共18分)制取氨气并完成喷泉实验(图中夹持装置均以略去)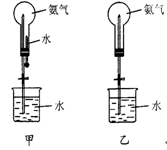
(1)写出氨气催化氧化的化学方程式:。
(2)收集氨气使用方法,要得到干燥的氨气可选用做干燥剂。
(3)用甲装置进行喷泉实验,上部烧瓶已装满干燥氨气,引发水上喷的操作是。
该实验的原理是 。
(4)如果只提供乙图装置,请设计引发喷泉的方法:。