(6分)随着我国工业化水平的不断发展,研究空气污染、废水处理等问题成为重要课题。
(1)NH3催化还原氮氧化物(SCR)技术是目前应用最广泛的烟气氮氧化物脱除技术。反应原理如图所示: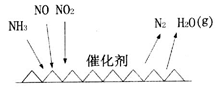
①SCR技术中的氧化剂为____________
②当NO2与NO的物质的量之比为1:l时,与足量氨气在一定条件下发生反应。该反应的化学方程式为_______。当有3 mol电子发生转移时,则参与反应的NO的物质的量为________。
(2)电镀废水中常含有毒的NaCN、HCN等。NaCN水溶液显碱性的原因是_____________(用离子方程式表示);HCN的Ka=6.17×10-10,用NaOH溶液调节含CN-的废水至pH=9,此时废水中c(CN-)_______c(HCN)(填“>”、“<”或“=”)。
(3)室温下有如下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的电离平衡常数K=1.75×10-5;碳酸的电离平衡常数K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4)=5.0×10-9;Ksp (CaCO3)=2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是___________;
②向0.6 mol·L-1的Na2CO3溶液中加入足量CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq)+ CaC2O4 (s) CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
CaCO3 (s)+ C2O42-(aq),静置后沉淀转化达到平衡,此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应)为_____________。
物质A是一种高熔点化合物,不溶于硫酸,硝酸等强酸。A与纯碱熔融反应,生成化合物B,同时放出气体C;把气体C通过B的溶液中,则得到化合物D;D在干燥空气中转变为化合物E;将E加热又得到化合物A。试写出A、B、C、D、E的化学式:A____、B____、C____、D____、E____。
针对以下A~D四个涉及H2O2的反应(未配平),填写空白
| A.Na2O2+HCl——H2O2+NaCl |
| B.Ag2O+H2O2——Ag+O2+H2O |
C.H2O2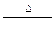 H2O+O2 H2O+O2 |
| D.H2O2+Cr2(SO4)3+KOH——K2CrO4+K2SO4+H2O |
(1)H2O2仅体现氧化性的反应是(填代号) 。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号) 。
(3)H2O2体现弱酸性的反应是(填代号) ,其理由为 。
臭氧(O3)是一种有点腥气味的淡蓝色气体,它具有比氧气更强的氧化性。臭氧能使湿润的淀粉碘化钾试纸变蓝,反应中有氧气产生,这个反应的化学方程式是: ,这个反应的氧化产物是 ,还原产物是 。
如何用所提供的试剂和方法除去各粉末状混合物中的杂质(括号内为杂质)。将所选答案的编号填入在表内相应的空格内(如果不需要外加试剂,则对应答案栏可空着)。
1.可供选择的试剂:
| A.盐酸 | B.氢氧化钠溶液 | C.氧气 | D.水 E.二氧化碳 |
Ⅰ.可选用的操作:①水洗 ②加热 ③高温灼烧 ④过滤 ⑤结晶
漂白粉在潮湿的空气中易变质失效,请回答:存放环境中①有水蒸气无二氧化碳②有二氧化碳无水蒸气,哪种情况下漂白粉更易变质?为什么?