选考(12分)【化学——化学与技术】
(1)目前,我国采用“接触法”制硫酸。有关接触法制硫酸的下列说法中,正确的是_________。
| A.二氧化硫的接触氧化在转化器中发生 |
| B.吸收塔中得到的硫酸质量分数为98% |
| C.煅烧含硫48%的黄铁矿时,若FeS2损失了2%,则S损失4% |
| D.转化器中适宜条件是V2O5,催化剂、高温、常压 |
E.转化器中采取高温是为了提高催化剂的活性和提高SO2的转化率
(2)硫酸工厂排放的尾气中含少量二氧化硫。为防止污染大气,在排放前必须进行尾气处理并设法进行综合利用。硫酸工厂排放尾气中的SO2可用足量石灰水吸收,然后再用稀硫酸处理。
①写出上述过程发生反应的化学方程式:_____________;
②若某硫酸厂每天排放的1万立方米(标准状况)尾气中含0.2%(体积分数)的SO2,通过上述方法处理,理论上需生石灰_____________Kg。
(3)某研究小组用NaOH溶液吸收尾气中的二氧化硫,将所得的Na2SO3溶液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图所示,a、b离子交换膜将电解槽分为三个区域,电极材料为石墨。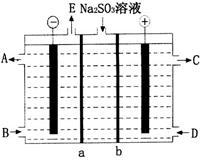
①图中b表示__________(填“阴”或“阳”)离子交换膜。A~E分别代表生产中的原料或产品,其中C为硫酸,则E表示__________;
②阳极的电极反应式为________________。
下图是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
| ① |
⑩ |
② |
③ |
||||||||||||||
| ④ |
⑤ |
⑦ |
⑧ |
⑨ |
|||||||||||||
| ⑥ |
|||||||||||||||||
⑴在这10种元素中,原子半径较小的是________(填元素符号),化学性质最不活泼的元素是_____(填“元素符号”);其中一种核素可测定文物年代,这种核素的符号是。
⑵元素①的原子结构示意图为__________;元素①的最高价氧化物结构式为:________,
请用电子式表示化合物④和⑧的形成过程________________________________________________。
⑶元素⑤的单质与氢氧化钠溶液反应的化学方程式为:________________________________。
⑷元素⑤的单质与Fe和稀硫酸构成原电池,写出负极的电极反应为___________________________。
(5)元素⑧单质能溶于水,水液呈色,在其中通入元素⑦的某种氧化物,溶液颜色褪去,用化学方程式表示原因。
(6)在一定条件下,元素⑦与H2反应有一定限度(可理解为反应进行的程度),请判断在相同条件下元素⑥与H2反应的限度(选填“更大”、“更小”或“相同”) 。
(12分)合成气的主要成分是一氧化碳和氢气,可用于合成二甲醚等清洁燃料。从天然气获得合成气过程中可能发生的反应有:
①CH4(g)+H2O(g) CO(g)+3H2(g)⊿H1="+206.1" kJ/mol
CO(g)+3H2(g)⊿H1="+206.1" kJ/mol
②CH4(g)+CO2(g) 2CO(g)+2H2(g)⊿H2="+247.3" kJ/mol
2CO(g)+2H2(g)⊿H2="+247.3" kJ/mol
③CO(g)+H2O(g) CO2(g)+ H2(g)⊿H3
CO2(g)+ H2(g)⊿H3
请回答下列问题:
(1)在一密闭容器中进行反应①,测得 的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是。
的物质的量浓度随反应时间的变化如图1所示。10min时,改变的外界条件可能是。
(2)如图2所示,在甲、乙两容器中分别充入等物质的量的 和
和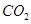 ,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中
,使甲、乙两容器初始容积相等。在相同温度下发生反应②,并维持反应过程中温度不变。已知甲容器中 的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中
的转化率随时间变化的图像如图3所示,请在图3中画出乙容器中 的转化率随时间变化的图像。
的转化率随时间变化的图像。
(3)反应③中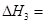 。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
。800℃时,反应③的化学平衡常数K=1.0,某时刻测得该温度下的密闭容器中各物质的物质的量见下表:
此时反应③中正、逆反应速率的关系式是(填代号)。
a. (正)
(正) (逆) b.
(逆) b. (正)<
(正)< (逆) c.
(逆) c. (正)=
(正)= (逆) d.无法判断
(逆) d.无法判断
(4)800K时下列起始体积相同的密闭容器中充入2mol SO2、1mol O2,其反应是2SO2(g)+O2(g)  2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。
2SO3(g);△H=-96.56 kJ•mol-1,甲容器在反应过程中保持压强不变,乙容器保持体积不变,丙容器维持绝热,三容器各自建立化学平衡。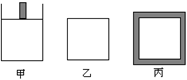
【1】达到平衡时,平衡常数K (甲)K (乙)K(丙)(填“>”、“<”或“=”)。
【2】达到平衡时SO2的浓度C(SO2)(甲)C(SO2) (乙)C(SO2) (丙)(填“>”、“<”或“=”)。
常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol·L-1) |
NaOH物质的量浓度(mol·L-1) |
混合溶液的pH |
| 甲 |
0.2 |
0.2 |
pH=a |
| 乙 |
c1 |
0.2 |
pH=7 |
| 丙 |
0.2 |
0.1 |
pH>7 |
| 丁 |
0.1 |
0.1 |
pH=9 |
请回答:(1)不考虑其他组的实验结果,单从甲组情况分析,如何用a(混合溶液的pH)来说明HA是强酸还是弱酸:
_________________________________________________________。
(2)不考虑其他组的实验结果,单从乙组情况分析,c1是否一定等于0.2 mol·L-1?______(选填“是”或“否”)。混合溶液中离子浓度c(A-)与c(Na+)的大小关系是________。
A.前者大 B.后者大 C.二者相等 D.无法判断
(3)从丙组实验结果分析,HA是______酸(选填“强”或“弱”)。该混合溶液中离子浓度由大到小的顺序是____________。
(4)写出丁组实验所得混合溶液中下列算式的精确结果(不能做近似计算)。
c(Na+)-c(A-)=____________mol·L-1;
c(OH-)-c(HA)=____________mol·L-1。
2SO2(g)+O2(g) 2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
2SO3(g)反应过程的能量变化如图所示。已知1 mol SO2(g)氧化为1 mol SO3(g)的ΔH1=-99 kJ·mol-1
请回答下列问题:
(1)该反应属于________反应(填“放热”或“吸热”)。
(2)图中C表示。
(3)从化学键的角度分析,F代表什么意义?F;
(4)改变反应条件可改变E值大小,如加入V2O5作催化剂,可使E值减小。E的大小对该反应的反应热有。(无影响、有影响、不确定)
(5)图中ΔH=________kJ·mol-1。
(6)若已知1 mol SO2(g)氧化为1 mol SO3(l)的ΔH2=-Q kJ·mol-1,则ΔH1______ΔH2(填“>”、“<”或“=”)。
(第(1)小题每空1分,其余每空2分,共12分)
A、B、C、D四种短周期元素,原子序数依次增大,A、C同主族,C、D同周期,B原子最外层电子数是最内层电子数的3倍。A、B可形成A2B和A2B2两种液态化合物,B、C也可形成C2B和C2B2两种固态化合物。C+具有与氖原子相同核外电子排布。D原子最外层电子数比B原子最外层电子数多一个电子,根据以上条件,判断:
(1)四种元素分别是(写元素符号) A B C D
(2)用电子式写出A2B化合物的形成过程___; 用电子式写出C2B化合物的形成过程___;
(3)A2B2中加少量MnO2反应的化学方程式________;C2B2与CO2反应的化学方程_____。