用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液进行中和反应。通过测定反应过程中所放出的热量可计算中和热。用相同浓度和体积的氨水(NH3·H2O)代替NaOH溶液进行上述实验,测得的中和热的数值会
A.偏大 B.偏小 C.无影响
下列说法在一定条件下可以实现的是( )
①酸性氧化物与碱发生反应②没有水生成,也没有沉淀和气体生成的复分解反应
③弱酸与盐溶液反应可以生成强酸④两种酸溶液充分反应后的溶液体系为中性
⑤有单质参加的非氧化还原反应⑥两种氧化物反应的产物有气体
| A.①②③④⑤⑥ | B.②④⑤⑥ | C.①②③⑤ | D.③④⑤⑥ |
V L Fe2(SO4)3溶液中含Fe3+m g,则溶液中SO42-的物质的量浓度为( )
A.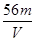 mol·L-1 B.
mol·L-1 B.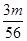 V mol·L-1C.
V mol·L-1C.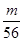 V mol·L-1 D.
V mol·L-1 D.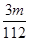 V mol·L-1
V mol·L-1
除去下列物质中少量杂质的方法不正确的是( )
| A.除去FeCl2溶液中混有的FeCl3:加入过量铁粉,过滤 |
| B.除去CO2中混有的HCl:用饱和NaHCO3溶液洗气 |
| C.除去BaCO3固体中混有的BaSO4:加入过量的盐酸、过滤、洗涤 |
| D.除去乙炔中混有的少量H2S、PH3:通过CuSO4溶液后,洗气 |
用NA表示阿伏加德罗常数,下列叙述正确的是( )
| A.标准状态下,22.4 L C4H6中含有碳碳叁键数一定为NA |
| B.含1molFeCl3的饱和溶液滴入沸水中得到氢氧化铁胶体粒子数目为NA |
| C.在标准状况下,22.4 L辛烷中所含分子数为NA |
| D.106 g Na2CO3固体中的阴离子数为NA |
用98%的浓H2SO4(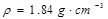 )配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
)配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
① 玻璃棒② 胶头滴管③ 100mL容量瓶④ 托盘天平⑤ 50mL烧杯⑥10mL量筒
⑦ 100mL量筒⑧ 移液管⑨ 滴定管
| A.⑥③⑧⑤①② | B.⑥⑤③①⑨② | C.④⑤③②①⑨ | D.⑥⑤①③② |