下列说法中错误的是
| A.原子及其离子的核外电子层数等于该元素所在的周期数 |
| B.元素周期表中从ⅢB族到ⅡB族10个纵列的元素都是金属元素 |
| C.除氦外的稀有气体原子的最外层电子数都是8 |
| D.同一元素的各种同位素化学性质几乎完全相同 |
下列物质分类正确的是()
| A.SO2、SiO2、 CO均为酸性氧化物 | B.稀豆浆、硅酸、氯化铁溶液均为胶体 |
| C.烧碱、冰醋酸、四氯化碳均为电解质 | D.福尔马林、水玻璃、氨水均为混合物 |
下列关于粒子结构的描述不正确的是( )
| A.H2S和NH3均是价电子总数为8的极性分子 |
| B.HS-和HCl均是含有一个极性键的18电子粒子 |
| C.CH2Cl2和CCl4均是四面体构型的非极性分子 |
D.1 mol  DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) DO中含中子、质子、电子各10NA(NA代表阿伏加德罗常数的值) |
咖啡鞣酸具有较广泛的抗菌作用,其结构简式如下图示:关于咖啡鞣酸的下列叙述不正确的是( )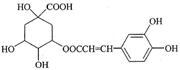
| A.分子式为C16H18O9 |
| B.与苯环直接相连的原子都在同一平面上 |
| C.1 mol咖啡鞣酸水解时可消耗8mol NaOH |
| D.与浓溴水既能发生取代反应又能发生加成反应 |
足量铜与一定量浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5mol/LNaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
| A.60 mL | B.45 mL | C. 30 mL | D. 15 mL |
用4种溶液进行实验,下表中“操作及现象”与“溶液”对应关系错误的是()
| 选项 |
操作及现象 |
溶液 |
| A |
通入CO2,溶液变浑浊。再升高至65℃以上,溶液变澄清。 |
C6H5ONa溶液 |
| B |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失。 |
Na2SiO3溶液 |
| C |
通入CO2,溶液变浑浊。再加入品红溶液,红色褪去。 |
Ca(ClO)2溶液 |
| D |
通入CO2,溶液变浑浊。继续通CO2至过量,浑浊消失,再加入足量NaOH溶液,又变浑浊。 |
Ca(OH)2溶液 |