某研究小组利用下图所示装置探究碳的氧化物的性质(固定装置略)。已知碳酸镁加热发生类似碳酸钙的分解反应。
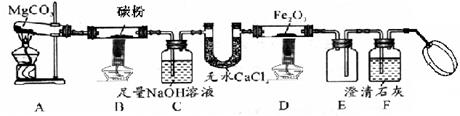
(1)装置
中发生的反应:(用化学方程式表示)。
(2)装置
的作用:,无水
的作用:。
(3)装置
中发生的反应:(用化学方程式表示)。
(4)图中装置
是安全瓶,能防倒吸,从实验安全考虑,本实验还应在装之间添加装置
。
(11分)小亮在做“盐酸中和氢氧化钠溶液”的实验时,滴加盐酸前忘了加入指示剂,导致无法判断该中和反应进行的程度。于是他对所得溶液的酸碱性进行探究。
【探究目的】探究所得溶液的酸碱性
【提出猜想】所得溶液可能呈碱性,也可能呈性,还可能呈性。
【实验验证】
| 实验操作 |
实验现象 |
结论 |
| 用试管取该溶液1-2mL,滴入1-2滴无色酚酞试液,振荡 |
无色酚酞试液变 |
溶液呈碱性 |
| 无色酚酞试液不变色 |
溶液呈 |
【分析与思考】
⑴若溶液呈碱性,则溶液中使其呈碱性的离子是(填写微粒符号),为避免碱性溶液污染环境,小亮对所得溶液进行了如下处理:向溶液中逐滴加入溶液,直到不再产生沉淀为止。然后过滤,把滤液倒入蒸发皿中加热,得到氯化钠晶体,该过程涉及的化学方程式为。
⑵若无色酚酞试液不变色,为了进一步确定溶液的酸碱性,小亮提出了以下方案:
方案一:取样,加入碳酸钠溶液,若观察到,则所取溶液呈酸性;若无明显现象,则呈中性。
方案二:取样,加入金属锌,若有所泡产生,则所取溶液呈酸性,该反应的化学方程式为;若无明显现象,则呈中性。
某化学实验室有一瓶失去标签的碱溶液,可能是氢氧化钠或氢氧化钙溶液;小王同学认为是氢氧化钙溶液。请你按小王同学的猜想,进行下列实验探究,并按要求填写写表:
| 猜想 |
实验步骤 |
实验现象 |
结论与相应的化学方程式 (若不反应可不写化学方程式) |
| 可能 是氢 氧化 钙溶 液 |
方案Ⅰ: 用试管取约2mL该溶 液,向其中滴加几滴 ____________溶液 |
_______________ |
该溶液是_______________, 化学方程式: __________________________ |
| 方案Ⅱ:(选用与方案Ⅰ 不同类别的其他物质) ____________________ ____________________ |
_______________ |
该溶液是_______________, 化学方程式: __________________________ |
某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动。
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是淡黄色粉末,不溶于水;②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成碱和一种气体;在呼吸面具中和潜水艇里常用作供氧剂。
【猜想与探究】猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物。
探究:过氧化钠与水反应的生成物的成分。
【实验与结论】
| 实验操作 |
实验现象 |
实验结论 |
|
| 猜想 |
在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 |
_____________________ |
猜想a、c不成立,猜想b成立。 |
| 探究 |
①用带火星的木条伸入过氧化钠与水反应的试管中 |
木条复燃 |
生成物有___________ |
| ②往①试管内的溶液中滴加___________ ______________ |
_____________________ |
生成物有氢氧化钠 |
【继续探究】小组的同学对过氧化钠能作为供氧剂也很感兴趣,大家讨论认为可能是CO2在常温下能与过氧化钠反应有关,于是设计右图所示的装置继续实验探究。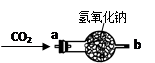
| 实验操作 |
实验现象 |
实验结论 |
| ①将CO2从a口处通入装置内,再把带火星的木条放在装置b口处 |
木条复燃 |
CO2在常温下能与过氧化钠反应,该反应的化学方程式为: ____________________________ |
| ②取出充分反应后的固体生成物于试管中,往试管内滴加稀盐酸,将生成的氢气通入澄清石灰水中 |
有气泡产生 石灰水变浑浊 |
【交流与比较】与我们学过的制氧气方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的主要理由是(从两个不同角度回答):________________________________、________________________________。
下图是实验室中用于制取和收集气体的装置图。
(1)写出上图中带标号仪器的名称:①__________,②__________。
(2)用高锰酸钾制取氧气,发生装置选择__________(填序号,下同),反应的化学方程式是________________________,用C装置收集氧气的依据是_____________________。
(3)实验室制取二氧化碳,应选用的固体药品是__________,收集装置选择__________。
2009年4月下旬以来,世界上一部分国家陆续出现甲型H1N1流感病例。达菲是目前抗该流感病毒的有效药物之一,它是以我区的特产中药材八角的提取物——莽草酸(化学式为C7H10O5)为原料经过化学反应合成的。请你回答下列问题:
(1)莽草酸属于__________(填“有机物”或“无机物”),每个莽草酸分子中有__________个原子。
(2)由上述材料得知,化学科学在促进人体健康方面所起的作用是__________________。