氮(N)元素与多种元素可以形成多种化合物。
(1)NH4Cl受热分解时克服的化学键有 ;NH4Cl晶体不能导电的原因是 。
(2)N、H元素除了可以形成10电子分子NH3外,还可形成18电子分子肼,肼的结构简式为NH2—NH2。若将肼分子中的2个H原子替换为甲基(—CH3),所得分子的结构简式可能为 、 。
(3)平面型BF3很容易与特定化合物[如N(CH3)3]以配位键形成四面体配位化合物,请在下图中用“→”标出B、N原子间存在的配位键。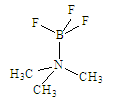
(4)氮化硼(BN)是一种新型无机非金属材料,氮化硼有两种重要晶型A型和B型。A型氮化硼硬度很高,是特殊的耐磨和切削材料;B型氮化硼化学稳定性较好,是一种优良的润滑剂。A型氮化硼结构下图中 (选填“I”或“Ⅱ”)所示。工业上氮化硼以三氯化硼、氢气、氮气为原料,在高温条件下反应制得,写出该反应的化学方程式 。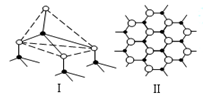
(5)氢氧化铜与氨水形成铜氨溶液,已知[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为 (选填“平面四边形”或“正四面体”)。[Cu(NH3)2]+在空气中立即转化为深蓝色的[Cu(NH3)4]2+,简述发生转化的可能原因 。
(6)向[Cu(NH3)4]SO4溶液中通入SO2至微酸性,有白色沉淀生成。该沉淀包含一种正四面体型的阳离子和一种三角锥型的阴离子,摩尔质量为162g/mol,且Cu、S、N的物质的量之比为1:1:1,则该白色沉淀的化学式为 。
为了回收利用钢铁生产过程中产生的SO2,工业上采用软锰矿(主要成分MnO2)脱硫同时制取硫酸锰技术,其流程示意图如下:
已知:浸出液的pH接近4,其中的金属离子主要是Mn2+,还含有少量的Fe2+。完成下列填空。
(1)写出浸出过程中主要反应的化学方程式:。
(2)浸出过程的副反应之一是部分SO2被氧化为硫酸,致使浸出液的pH下降,这将(“有利”、“不利”)于软锰矿浆继续吸收SO2。欲消除生成的硫酸,试剂A最好是。
a.MnCO3 b.MnO2 c.CaO d.CaCO3
(3)操作I的目的是除去浸出液中的Fe2+,MnO2在氧化Fe2+的同时还,使Fe3+沉淀。检验过滤后溶液中是否含有Fe3+的操作是。
(4)已知大于27℃时,MnSO4·H2O溶解度随温度上升而明显下降,则操作II的过程为:、、洗涤、干燥。工业上为了充分利用锰元素,在流程中可循环使用。
(5)通过煅烧MnSO4·H2O 可制得生产软磁铁氧体材料的MnxO4,如图是煅烧MnSO4·H2O时温度与剩余固体质量变化曲线。该曲线中A段所表示物质的化学式为;MnxO4中x=。
铁及其化合物在生产、生活中存在广泛用途,完成下列填空。
(1)如图所示为铁元素在周期表中的信息,方格中“55.85”的意义为:。铁原子核外有种运动状态不同的电子。
(2)二茂铁[Fe(C5H5)2]是一种有机金属化合物,熔点172℃,沸点249℃,易升华,难溶于水易溶于有机溶剂。二茂铁属于晶体;测定表明二茂铁中所有氢原子的化学环境都相同,则二茂铁的结构应为图中的(选填“a”或“b”)。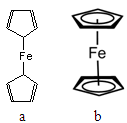
(3)绿矾(FeSO4·7H2O)可用于治疗缺铁性贫血,其水溶液露置于空气中会变质,
写出发生变质反应的离子方程式。
(4)无水FeCl3是水处理剂,遇潮湿空气即产生白雾,易吸收空气中的水分成为结晶氯化铁(FeCl3·6H2O)。制备无水FeCl3的试剂是。
(5)高铁酸盐也是常用的水处理剂。高铁酸钠(Na2FeO4)可用如下反应制备:
2FeSO4 + 6Na2O2 → 2Na2FeO4 + 2Na2O + 2Na2SO4 + O2↑,若生成2mol Na2FeO4,则反应中电子转移的物质的量为mol。
(6)高铁酸盐可将水体中的Mn2+氧化为MnO2进行除去,若氧化含 Mn2+ 1mg的水体样本,需要1.2 mg/L高铁酸钾L。
液化石油气中常存在少量有毒气体羰基硫(COS),必须将其脱除以减少环境污染和设备腐蚀。完成下列填空。
(1)写出羰基硫的电子式,羰基硫分子属于(选填“极性”、“非极性”)分子。
(2)下列能说明碳与硫两元素非金属性相对强弱的是。
a.相同条件下水溶液的pH:Na2CO3>Na2SO4
b.酸性:H2SO3>H2CO3
c.CS2中碳元素为+4价,硫元素为-2价
(3)羰基硫在水存在时会缓慢水解生成H2S,对钢铁设备产生电化学腐蚀。写出正极的电极反应式 ,负极的反应产物为(填化学式)。
为除去羰基硫,工业上常采用催化加氢转化法,把羰基硫转化为H2S再除去:COS + H2 CO + H2S
CO + H2S
(4)已知升高温度,会降低羰基硫的转化率。则升高温度,平衡常数K,反应速率(均选填“增大”、“减小”、“不变”)。
(5)若反应在恒容绝热密闭容器中进行,能说明该反应已达到平衡状态的是。
a.容器内气体密度保持不变 b.容器内温度保持不变
c.c(H2)=c(H2S)d.υ(H2)正=υ(H2S)正
(6)已知该反应的平衡常数很大,说明。
氢气还原氧化铜所得的红色固体可能是铜与氧化亚铜的混合物,已知Cu2O在酸性溶液中可发生自身氧化还原反应,生成Cu2+和Cu。
(1)现有8.4克氧化铜被氢气完全还原后,得到红色固体6.96克,其中含单质铜与氧化亚铜的物质的量之比是;
(2)若将6.96克上述混合物与足量的浓硝酸充分反应:
①生成标准状况下1.568升的气体(不考虑NO2的溶解,也不考虑NO2与N2O4的转化),则该气体的成分是,其物质的量之比是;
②把得到的溶液小心蒸发浓缩,把析出的晶体过滤,得晶体20.328g。经分析,原溶液中的Cu2+有20%残留在母液中,所得晶体的化学式为。
(3)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6mol/L HNO3溶液恰好使混合物完全溶解,同时收集到224mL NO气体(标准状况)。如原混合物中Cu的物质的量为X,求其中Cu2O、CuO的物质的量及X的取值范围(写出解题过程)。
乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化为烃B、烃C。以C为原料可以合成聚对羟基苯甲酸 (G)。已知:
①A是一种有机酸,分子式为C9H10O3。
②B的相对分子质量为104,分子中含苯环且能使溴的四氯化碳溶液褪色。
③C的相对分子质量为78,且分子中只有一种氢原子。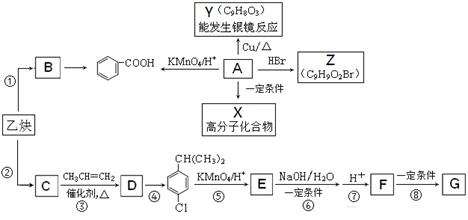
(1)写出乙炔分子的电子式, F中的含氧官能团名称;
(2)上述①至⑧的反应中,属于加成反应的有,第④步反应所需的试剂和条件是;
(3)写出A的结构简式;
(4)下列有关的描述中,正确的是;
a. 1molB最多能与4molH2加成
b. B通过氧化反应可使溴水和酸性KMnO4溶液褪色
c. B、C、D是同系物
d. A→X的反应属于缩聚反应
(5)写出F→G反应的化学方程式。