短周期主族元素M、N、X、Y、Z的原子序数依次增大。又知M与X同主族,N原子的最外层电子数是电子层数的3倍,M原子的原子半径小于N原子的原子半径,Z的原子半径在同周期元素中是最小的,Y原子的电子层数与最外层电子数相等。下列叙述正确的是
| A.单质的还原性:Y>X |
| B.元素M与N只能形成一种共价化合物 |
| C.通常状况下,元素Z的单质不能与元素M的氧化物反应 |
| D.元素X、Y、Z的最高价氧化物对应的水化物彼此间均可发生反应 |
200℃时,11.6 g CO2和H2O的混合物气体与足量的Na2O2反应,反应后固体增加了3.6 g,则原混合物的平均相对分子质量为
| A.5.8 | B.11.6 | C.23.2 | D.36.4 |
某同学为检验某溶液中是否含有常见的四种无机离子,进行了下图所示的实验操作.其中检验过程中产生的气体能使湿润的红色石蕊试纸变蓝.由该实验能得到的正确结论是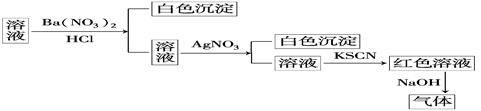
| A.原溶液中一定含有SO | B.原溶液中一定含有NH |
| C.原溶液中一定含有Cl- | D.原溶液中一定含有Fe3+ |
如图是课外活动小组的同学设计的4个喷泉实验方案.下列有关操作不 可能引发喷泉现象的是
可能引发喷泉现象的是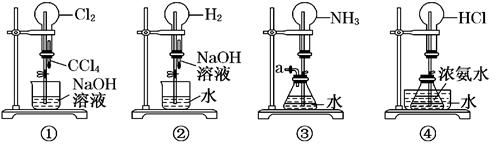
A.挤压装置① 的胶头滴管使CCl4全部进入 的胶头滴管使CCl4全部进入 烧瓶,片刻后打开止水夹 烧瓶,片刻后打开止水夹 |
| B.挤压装置②的胶头滴管使NaOH溶液全部进入烧瓶,片刻后打开止水夹 |
| C.用鼓气装置从装置③的a处不断鼓入空气并打开止水夹 |
| D.向装置④的水槽中慢慢加入足量浓硫酸并打开止水夹 |
在浓盐酸中H3AsO3与SnCl2反应的离子方程式为: 3SnCl2+12Cl-+2H3AsO3+6H+===2As+3SnCl+6M,关于该反应的说法中正确的组合是:
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成7.5 g As,还原剂失去的电子为0.3 mol ④M为OH- ⑤SnCl是氧化产物
| A.①③⑤ | B.①②④⑤ | C.①②③④ | D.①③ |
某 元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键
元素的原子最外层只有一个电子,它跟卤素结合时,所形成的化学键
| A.一定是离子键 | B.一定是共价键 |
| C.可能是离子键,也可能是共价键 | D.可能不形成化学键 |