某学生实验小组,用稀硫酸和稀氢氧化钠溶液在下图所示的装置中,进行中和反应反应热的测定。请回答下列问题:
(1)图中装置缺少一种仪器,该仪器名称为_ _。
(2)写出该反应的热化学方程式(中和热为57.3kJ·mol-1):__________________。
(3)如果用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热的数值将__________(填“偏大”、“偏小”或“无影响”)。
为了证明铜与稀硝酸反应产生的是NO,某校学生实验小组设计了一个实验,其装置如下图所示(加热装置和固定装置均已略去),B为一个用金属丝固定的干燥管,内装块状碳酸钙固体;E为一个空的蒸馏烧瓶;F是用于鼓入空气的打气球。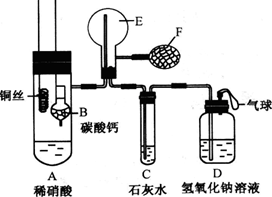
(1)实验时,为在E烧瓶中收集到NO,以便观察颜色,必须事先除去其中的空气。其中第一步实验操作为: 。从装置的设计看,确定E中空气已被赶尽的实验现象是 。
(2)将A中铜丝放入稀硝酸中,给装置A微微加热,在装置A中产生无色气体,其反应的离子方程式为 。有人认为E中收集到的可能是H2而不是NO,如何证明? 。
(3)实验过程中,发现在未鼓入空气的情况下,E中就产生红棕色。有人认为是由装置E部分设计不当造成的。你认为装置应改进的地方是 。
(4)装置D的作用是 。
海水中化学资源的利用具有非常广阔的前景。
(1)目前世界上60%的镁是从海水中提取的,其主要步骤如下: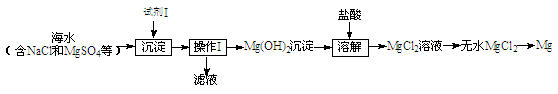
①试剂Ⅰ适宜选用 (填序号)。
A.盐酸 B.石灰乳 C.氯化钠溶液
②操作Ⅰ的名称是 。
③工业上通过电解熔融的MgCl2制备金属Mg,该反应的化学方程式是 。
(2)下图是某课外小组在实验室模拟从海水中提取溴的实验装置。
A装置中通入Cl2一段时间后,改通热空气,将Br2吹出至B装置。
①A装置中发生反应生成Br2的离子方程式为 。
②B装置中,Br2被SO2还原,B装置中产生的两种主要阴离子的符号为 、 。
③C装置中NaOH溶液的作用是 。
碘是人类必需的生命元素,在人体的生长发育过程中起着重要作用。
(1)人体中碘的重要来源之一是加碘食盐。加碘食盐中的碘元素以碘酸钾(KIO3)的形式存在,其碘元素的化合价是__________。加碘食盐的食用方法是“待食品熟后加入”,说明碘酸钾在受热时易__________。
(2)海带或海苔中含有丰富的碘元素,也是人体碘的一种来源。取海带灰的浸取液加硫酸酸化,再加入少量H2O2溶液与淀粉溶液,溶液变蓝,证明海带中含有碘元素。反应的离子方程式是________。
(3)2012年3月,北京市最新规定食盐中碘含量标准为(18~33)mg/kg。为测定加碘食盐样品的碘含量,某实验小组设计了如下步骤:
I. 用天平准确称取10.0 g食盐样品,加适量蒸馏水使其完全溶解。
II. 用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全。
III. 以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液6.0 mL,恰好反应完全。(已知: )
)
①步骤II中反应的离子方程式是__________。
②步骤III中判断反应恰好完全的现象是__________。
③上述实验样品中碘含量是__________mg/kg,符合北京市规定。
1,2-二溴乙烷在常温下是无色液体,密度是2.18g/cm ,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。
,沸点是131.4℃,熔点是9.79℃,不溶于水,易溶于醇、丙酮等有机溶剂。在实验室中可以用下图所示装置来制备1,2-二溴乙烷。其中试管c中装有液溴(表面覆盖少量水)。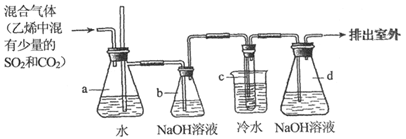
(1)写出制备1,2-二溴乙烷的化学方程式________。
(2)安全瓶a可以防止倒吸,并可以检查实验进行时试管c中导管是否发生堵塞。如果发生堵塞,a中的现象是__________。
(3)容器b中NaOH溶液的作用是__________,容器d中NaOH溶液的作用是__________。
(4)试管c浸入冷水中,以及液溴表面覆盖少量水的原因是__________。
(5)某同学在做实验时,使用一定量的液溴,当溴全部褪色时,通入的乙烯混合气体的量比正常情况下超出许多。如果装置的气密性没有问题,试分析可能的原因________________.
能源是现代社会发展的支柱之一。
(1)化学反应中的能量变化,通常主要表现为热量的变化。
①下列反应中,属于放热反应的是___________(填序号)。
a. Ba(OH)2·8H2O与NH4Cl混合搅拌
b. 高温煅烧石灰石
c. 铝与盐酸反应
②某同学进行如下图所示实验,测量稀盐酸与烧碱溶液中和反应的能量变化。实验表明:反应温度升高,由此判断该反应是_______(填“吸热”或“放热”)反应,其离子方程式是_______________。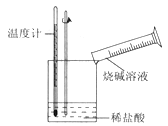
(2)电能是现代社会应用最广泛的能源之一。
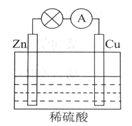
下图所示的原电池装置中,其负极是_____________________,正极上能够观察到的现象是___________________,正极的电极反应式是______________________。
原电池工作一段时间后,若消耗锌6.5g,则放出气体__________g。