工业制硫酸生产流程如下图:
(1)实验室常用过量的氢氧化钠溶液吸收SO2尾气,该反应的离子方程式为 。
(2)已知SO2和O2生成SO 3的反应过程放热。在催化反应室中,下列措施有利于提高SO2平衡转化率的有 。(填写编号)
A.减少压强 B.升高温度 C.不断补充空气 D.及时分离出SO3
(3)在工业制硫酸生产中,为提高催化剂效率采取的措施有 (答出2点)。
(4)在450℃、常压和钒催化条件下,在容积为2L的恒容容器中加入2molSO2和1molO2 。
①下列选项中不能作为判断该反应是否达平衡状态的标志的是 。(填写编号)
A.混合气密度不变化
B.SO2百分含量保持不变
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
E.气体总物质的量不变
②达平衡后,测得平衡常数为K,若此时O2的转化率为x,则K和x的关系满足K= 。
(5)SO2和O2的反应在恒容密闭容器中发生,图1、2表示在时刻t1达到平衡、在时刻t2因改变某个条件而发生变化的情况,根据图1、图2相关信息,判断t2发生改变的条件是 。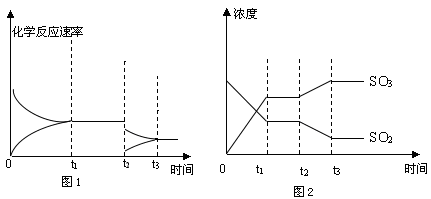
某工业废水中仅含下表离子中的5种(不考虑水的电离及离子的水解),且各种离子的物质的量浓度相等,均为0.1mol/L。
| 阳离子 |
K+ Cu2+ Fe3+ Al3+ Fe2+ |
| 阴离子 |
Cl-CO32- NO3- SO42- SiO32- |
甲同学欲探究废水的组成,进行了如下实验:
Ⅰ.用铂丝蘸取少量溶液,在火焰上灼烧,无紫色火焰(透过蓝色钴玻璃观察)。
Ⅱ.取少量溶液,加入KSCN溶液无明显变化。
Ⅲ.另取溶液加入少量盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
Ⅳ.向Ⅲ中所得的溶液中加入BaCl2溶液,有白色沉淀生成。
请推断:
(1)由Ⅰ、Ⅱ判断,溶液中一定不含有的阳离子是(写离子符号)。
(2)Ⅲ中加入少量盐酸生成无色气体的的离子方程式是_________________________。
(3)将Ⅲ中红棕色气体(标况下)收集一满试管然后倒扣入水中(假设溶质不扩散),所得溶液的物质的量浓度为mol/L(精确到千分位)
(4)甲同学最终确定原溶液中所含阳离子是,阴离子是。(写离子符号)
(5)另取100mL原溶液,加入足量的NaOH溶液,充分反应后过滤,洗涤,灼烧至恒重,得到的固体质量为g。
化学兴趣小组对某品牌牙膏中摩擦剂成分及其含量进行以下探究:
查得资料:该牙膏摩擦剂由碳酸钙、氢氧化铝组成;牙膏中其他成分遇到盐酸时无气体产生。
Ⅰ.摩擦剂中氢氧化铝的定性检验。取适量牙膏样品,加水充分搅拌、过滤。
(1)往滤渣中加入过量NaOH溶液,过滤,滤液中通入过量二氧化碳,请写出通入过量二氧化碳反应的离子方程式是___________,______________。
Ⅱ.牙膏样品中碳酸钙的定量测定。利用如图所示装置(图中夹持仪器略去)进行实验,充分反应后,测定C 中生成的BaCO3沉淀质量,以确定碳酸钙的质量分数。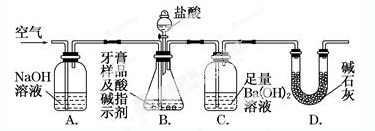
依据实验过程回答下列问题:
(2)实验过程中需持续缓缓通入空气。其作用除了可搅拌B、C中的反应物外,还有_________________
(3)C中反应生成BaCO3的化学方程式是_____________________________________
(4)下列各项措施中,不能提高测定准确度的是________(填标号)。
a.在加入盐酸之前,应排净装置内的CO2气体
b.滴加盐酸不宜过快
c.在A~B之间增添盛有浓硫酸的洗气装置
d.在B~C之间增添盛有饱和碳酸氢钠溶液的洗气装置
(5)实验中准确称取8.00 g样品三份,进行三次测定,测得BaCO3平均质量为3.94 g。则样品中碳酸钙的质量分数为______。
(6)有人认为不必测定C中生成的BaCO3质量,只要测定装置C在吸收CO2前后的质量差,就可以确定碳酸钙的质量分数。实验证明按此方法测定的结果明显偏高,原因是________。
铜在工农业生产中有着广泛的用途。
(1)配制CuSO4溶液时需加入少量稀H2SO4,其原因是(只写离子方程式)。
(2)某同学利用制得的CuSO4溶液,进行以下实验探究。
①图甲是根据反应Fe+CuSO4=Cu+FeSO4设计成铁铜原电池,请图甲中的横线上完成标注。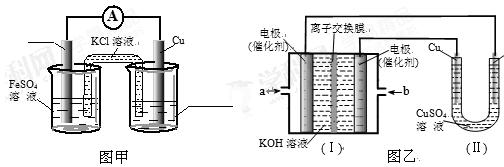
②图乙中,I是甲烷燃料电池的示意图,该同学想在II中实现铁上镀铜,则应在a处通入(填“CH4”或“O2”),b处电极上发生的电极反应式为==4OH-;
若把II中电极均换为惰性电极,电解液换为含有0.1molNaCl溶液400mL,当阳极产生的气体为448mL(标准状况下)时,溶液的pH= (假设溶液体积变化忽略不计)。
(3)电池生产工业废水中常含有毒的Cu2+等重金属离子,常用FeS等难溶物质作为沉淀剂除去[室温下Ksp(FeS)=6.3×10-18mol2·L-2,Ksp(CuS)=1.3×10-36mol2·L-2]。请结合离子方程式说明上述除杂的原理:当把FeS加入工业废水中后,直至FeS全部转化为CuS沉淀,从而除去溶液中Cu2+。
氮元素的化合物应用十分广泛。请回答:
(1)火箭燃料液态偏二甲肼(C2H8N2)是用液态N2O4作氧化剂,二者反应放出大量的热,生成无毒、无污染的气体和水。已知室温下,1 g燃料完全燃烧释放出的能量为42.5kJ,则该反应的热化学方程式为。
(2)298 K时,在2L固定体积的密闭容器中,发生可逆反应:2NO2(g) N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
N2O4(g)ΔH=-a kJ·mol-1 (a>0) 。N2O4的物质的量浓度随时间变化如图。达平衡时,N2O4的浓度为NO2的2倍,回答下列问题:
①298k时,该反应的平衡常数为L ·mol-1(精确到0.01)。
②下列情况不是处于平衡状态的是:
A.混合气体的密度保持不变; B.混合气体的颜色不再变化;C.气压恒定时。
③若反应在398K进行,某时刻测得n(NO2)="0.6" mol n(N2O4)=1.2mol,则此时V(正)V(逆)(填“>”、“<”或“=”)。
(3)NH4HSO4在分析试剂、医药、电子工业中用途广泛。现向100 mL 0.1 mol·L-1NH4HSO4溶液中滴加0.1 mol·L-1NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图所示。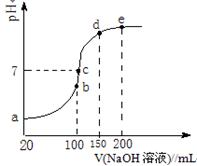
试分析图中a、b、c、d、e五个点,
①b点时,溶液中发生水解反应的离子是______;
②在c点,溶液中各离子浓度由大到小的排列顺序是。
(1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备甲醇。
①CH4(g)+H2O(g)=CO(g) + 3H2(g)△H =+206.0 kJ·mol-1
② CO(g)+2H2(g)=CH3OH (g)△H=-129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH (g)和H2(g)的△H=。
(2)将1.0 mol CH4和2.0 mol H2O ( g )通入容积为10 L的反应器,在一定条件下发生反应①,测得在一定压强下CH4的转化率与温度的关系如图。
假设100 ℃时达到平衡所需的时间为5 min,则用H2表示该反应的平均反应速率为mol·L-1·min-1。
(3)在某温度和压强下,将一定量 CO与H2充入密闭容器发生反应②生成甲醇,平衡后压缩容器体积至原来的l/2,其他条件不变,对平衡体系产生的影响是(填序号):
| A.c ( H2 )减少; |
| B.平衡常数K增大; |
| C.CH3OH 的物质的量增加; |
| D.正反应速率加快,逆反应速率减慢; |
E.重新平衡c ( H2 )/ c (CH3OH )减小。
(4)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后Co3+将甲醇氧化成CO2和H+(用石墨烯吸附除去Co2+)。现用图装置模拟上述过程,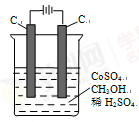
则:Co2+在阳极的电极反应式为:;除去甲醇的离子方程式为。