甲醇(CH3OH)是一种优质燃料,(1)已知一定条件下每1MolCO2和足量氢气完全反应可生成1Mol气态甲醇(CH3OH)和1Mol 水蒸汽并放出49 kJ的热量。请回答:
①该反应的热化学方程式: 。
②其反应过程中能量的变化与如图所示最相符的是 。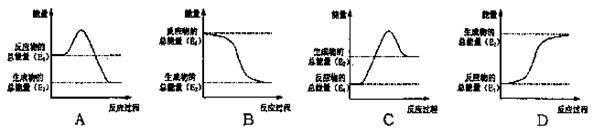
(2)为探究用CO2来生产燃料甲醇的反应原理,现进行如下实验:在体积为1L的密闭容器中,充入1MolCO2和3MolH2,一定条件下发生反应,测得CO2和CH3OH(g)的浓度随时间变化如图。
请回答: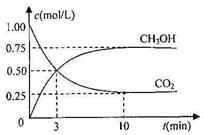
①从反应开始到平衡,甲醇和氢气的反应速率:
v(CH3OH)= 。
v(H2)= 。
②下列措施中能使v (CO2)增大的是 。
A.加入催化剂
B.充入He(g),使体系压强增大
C.将H2O(g)从体系中分离
D.升高温度
③能够说明该反应已达到平衡的是_________。
A.恒温、恒容时,容器内的压强不再变化
B.恒温、恒容时,容器内混合气体的密度不再变化
C.一定条件下,CO2、H2和CH3OH的浓度不再变化
D.一定条件下,单位时间内消耗3MolH2的同时生成1MolCH3OH
根据图示填空
(1)化合物A含 有的官能团是、、。
有的官能团是、、。
(2)1mol A与2mol H2反应生成1molE,其反应方程式是
。
(3)与A具有相同官能团的A的同分异构体的结构简式是。
(4)B在酸性条件下与Br2反应得到D,D的结构简式是。
(5)F的结构简式是。由E生成F的反应类型是。
下表是A、B、C、D、E五种有机物的有关信息: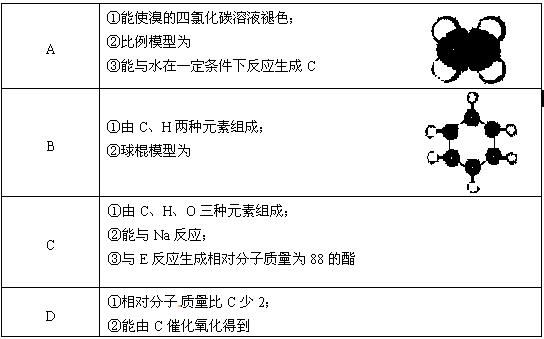
回答下列问题:
(1)A~E中,属于烃的是 (填字母)。
(填字母)。
(2)A能使溴的四氯化碳溶液褪色,发生反应的化学方程式为
。
(3)C催化氧化生成D的化学方程式为
。
(4)有机物B具有的性质是(填序号)。
①无色无味的液体;②有毒;③不溶于水;④密度比水大;⑤能使酸性KMnO4溶液和溴水褪色
(5)E的水溶液能使紫色石蕊试液变红,说明E的水溶液显酸性,现设计
一个实验来比较E与碳酸酸性的强弱,则该实验的原理是(用化学方程式说明)
。
(1 2分)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
2分)下表中括号内物质为所含的少量杂质,请选用适当的试剂和分离装置将杂质除去,并将所选的试剂及装置的编号填入表中。
试剂:①水 ;②氢氧化钠;③溴水;
;②氢氧化钠;③溴水;
分离装置: A、分液装置; B、蒸馏装置; C、洗气装置;
| 需加入的试剂 |
分离装置 |
|
| 苯(乙醇) |
||
| 乙烷(乙烯) |
||
| 乙醇(乙酸) |
(10分)在有机反应中,反应物相同而条件不同,可得到不同的主产物,下式中R代表烃基, 副产物均已略去。
副产物均已略去。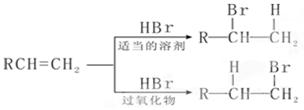
适当的溶剂(请注意H和Br所加成的位置)
请写出由CH3CH2CH2CH2Br分两步转变为CH3CH2CHBrCH3的反应的化学方程式,并注明反应类型
()
()
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1∶2。在一定条件下,各物质之间的相互转化关系如下(图中部分产物未列出):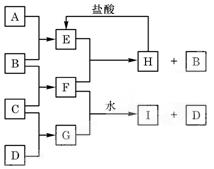
请填写下列空白
(1)A是,B是, C是 。
。
(2)H与盐酸反应生成E的化学方程式是。
(3)E与F反应的化学方程式是。
(4)F与G的水溶液反应生成I和D的离子方程式 是。
是。