已知反应AsO43—+2I-+2H+ AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
AsO32—+I2+H2O是可逆反应。设计如图装置(C1、C2均为石墨电极),分别进行下述操作:
Ⅰ.向B烧杯中逐滴加入浓盐酸
Ⅱ.向B烧杯中逐滴加入40% NaOH溶液
结果发现电流计指针均发生偏转。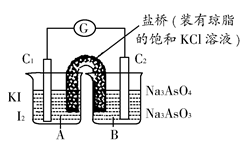
据此,下列判断正确的是 ( )
| A.操作Ⅰ过程中,C1为正极 |
| B.操作Ⅱ过程中,盐桥中的K+移向B烧杯溶液 |
| C.操作Ⅰ过程中,C2棒上发生的反应为:AsO43—+2H++2e-=AsO33—+H2O |
| D.操作Ⅱ过程中,C1棒上发生的反应为:2I-=I2+2e- |
如图中X为电源,Y为浸透饱和食盐水和酚酞试液的滤纸,滤纸中央滴有一滴KMnO4溶液,通电后Y中央的紫红色斑点向d端扩散。下列判断正确的是( )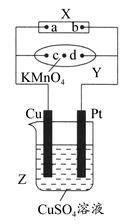
| A.滤纸上c点附近会变红色 |
| B.Cu电极质量减小,Pt电极质量增大 |
| C.Z中溶液的pH先减小,后增大 |
| D.溶液中的SO42—向Cu电极定向移动 |
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是 ( )
| A.未通电前上述镀锌装置可构成原电池,电镀过程是该原电池的充电过程 |
| B.因部分电能转化为热能,电镀时通过的电量与锌的析出量无确定关系 |
| C.电镀时保持电流恒定,升高温度不改变电解反应速率 |
| D.镀锌层破损后即对铁制品失去保护作用 |
下列图示中关于铜电极的连接错误的是 ( )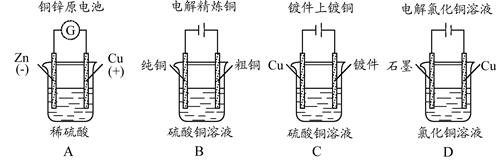
用石墨作电极电解200 mL CuSO4溶液,电解过程中电子转移的物质的量n(e-)与产生气体的体积V(g)(标准状况)的关系如图所示,下列说法正确的是 ( )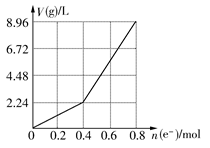
| A.电解前CuSO4溶液的物质的量浓度为2 mol/L |
| B.电解后所得溶液中c(H+)=2 mol/L |
| C.当n(e-)=0.6 mol时,V(H2):V(O2)=2:3 |
| D.向电解后的溶液中加入16 g CuO,则溶液可恢复为电解前的浓度 |