某酯的分子式为C6H12O2,其变化如图所示:若A能发生银镜反应,C不能发生银镜反应,则该酯的可能结构有 
| A.3种 | B.4种 | C.5种 | D.6种 |
化学反应N2+3H2===2NH3的能量变化如右图所示,该反应的热化学方程式是
| A.N2(g)+3H2(g)===2NH3(l) ΔH=2(a-b-c)kJ·mol- |
| B.N2(g)+3H2(g)===2NH3(g) ΔH=2(b-a)kJ·mol-1 |
| C.1/2 N2 (g)+3/2H2(g)===NH3(l) ΔH=(b+c-a)kJ·mol-1 |
| D.1/2 N2(g)+3/2H2(g)===NH3(g) ΔH=(a+b)kJ·mol-1 |
一定温度下,向容积恒定的密闭容器中投入2 mol A和1 mol B,发生如下可逆反应:2A(g)+B(g) C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为()
C(g)+D(s)。达到平衡时,测得压强为原压强的5/6。则A的转化率为()
| A.25% | B.40% | C.50% | D.75% |
已知0.1 mol·L-1的醋酸溶液中存在电离平衡:CH3COOH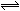 CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是 ( )
CH3COO-+H+,要使溶液中c(H+)/c(CH3COOH)的值增大,可以采取的措施是 ( )
①加少量烧碱溶液 ②升高温度 ③加少量冰醋酸④加水
| A.①② | B.①③ | C.②④ | D.③④ |
已知反应:3A(g)+B(g)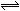 C(s)+4D(g),△H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线b变为曲线a,可采取的措施是()
C(s)+4D(g),△H<0。图中a、b曲线表示在一定条件下,D的体积分数随时间的变化情况。若使曲线b变为曲线a,可采取的措施是()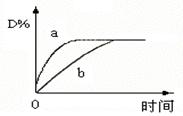
| A.升高温度 | B.缩小反应容器的体积 |
| C.增加C的质量 | D.减小B的浓度 |
已知在一密闭容器中充入1 mol CO2和3 mol H2,在高温时气体混合物达到平衡:CO2 + H2  CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为()
CO + H2O,已知达平衡时生成0.75 mol CO,则当H2 改为9 mol 时,在上述条件下重新达平衡时,生成CO和水蒸气物质的量之和可能为()
| A.2.0mol | B.1.5mol | C.1.8mol | D.2.5mol |