某小组同学要配制100 mL 0.100 mol·L-1 Na2CO3溶液。下图是一些关键步骤和操作。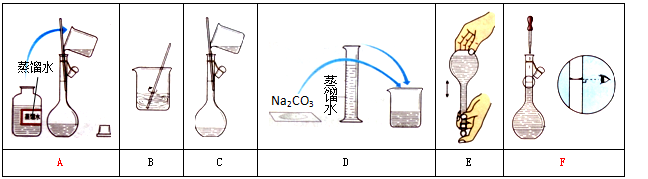
(1)配制过程的先后顺序为(用字母A~F填写) 。
(2)配制过程所需的玻璃仪器有烧杯、玻璃棒、量筒、 。
(3)若用Na2CO3·10H2O晶体来配制溶液,需要称量固体 ,但晶体已经部分失去结晶水,则所配得溶液的浓度会 (填“偏高”、“偏低”、“不变”)。
(4)步骤A通常称为洗涤,如果没有步骤A,则配得溶液的浓度将 (填“偏高”、“偏低”、“不变”);步骤F称为 ,如果俯视刻度线,配得溶液的浓度将 (填“偏高”、“偏低”、“不变”)。
(5)在步骤B之后,需 才进行下一步操作。
化学兴趣小组的同学设计实验探究浓硫酸与木炭反应后产生气体的成分。
(1)写出浓硫酸与木炭反应方程式,并标明电子转移的方向和数目:____________________。
【装置设计】组装如下的实验装置,然后进行实验探究。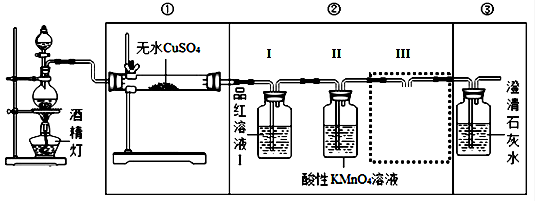
(2)装入反应物之前,必须先。
(3)要验证产生的气体中含有CO2,请在答题卡中完成图中虚线框内的装置简图,并标明试剂。
【实验探究】
(4)观察实验,完成实验现象的部分记录:
| 实验装置 |
① |
② |
③ |
| 实验现象 |
…… |
(5)实验装置②中品红溶液Ⅰ的作用,III的作用。
净水剂液体聚合硫酸铝铁兼具铁盐和铝盐的双重絮凝特性,一般是以铁盐为主,铝盐为辅。现用的铝土矿(其主要成分是Al2O3,含有少量杂质Fe2O3和SiO2,其他杂质忽略不计)来制备该净水剂,其工艺流程如下: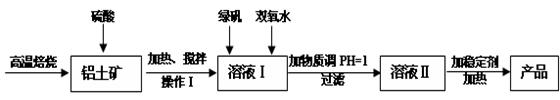
(1)H2SO4浓度的适宜范围是45%~50%,反应的适宜温度是100℃,其目的是:;Al2O3与H2SO4反应的化学反应方程式是__________。
(2)操作I为:冷却静置、、洗涤,所得到的溶液I中的金属阳离子有_______(填化学式)。
(3)溶液I中加入绿矾(FeSO4·7H2O)和双氧水的目的是:,涉及的反应离子方程式为__。
(4)钢材镀铝后,表面形成的致密氧化铝膜能防止钢材腐蚀,请在答题卡中完成钢材镀铝的装置示意图,并作相应标注。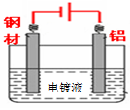
在常温下,Fe与水并不起反应,但在高温下,Fe与水蒸气可发生反应。 应用下列装置,在硬质玻璃管中放入还原铁粉和石棉绒的混合物,加热,并通入水蒸气,就可以完成高温下“Fe与水蒸气的反应实验”。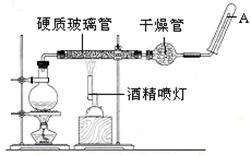
请回答该实验中的问题。
(1)写出该反应的反应方程式:;并指明该氧化还原反应的还原剂是,氧化剂是。
(2)实验前必须对整套装置进行气密性检查,操作方法是。
(3)圆底烧瓶中盛装的水,该装置受热后的主要作用是;烧瓶底部放置了几片碎瓷片,碎瓷片的作用是。
(4)干燥管中盛装是的物质是,作用是。
(5)试管中收集气体是,如果要在A处玻璃管处点燃该气体,则必须对该气体进行。
2010年8月7日,甘肃甘南藏族自治州舟曲县发生特大泥石流,造成大量人员伤亡,其中饮用水安全在灾后重建中占有极为重要的地位,某研究小组提取三处被污染的水源进行了如下分析:并给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质,A、B、C、D、E五种常见化合物都是由下表中的离子形成的:
| 阳离子 |
K+、Na+、Cu2+、Al3+ |
| 阴离子 |
SO 、HCO 、HCO 、NO 、NO 、OH- 、OH- |
为了鉴别上述化合物,分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液.
②将E溶液滴入到C溶液中,出现白色沉淀,继续滴加沉淀溶解.
③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃).
④在各溶液中加入Ba(NO3)2溶液,再加入过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀.
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验现象写出下列物质化学式:ABCDE。
(10分)为测定某碳酸氢钠样品纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1g样品),请回答每个方案中的问题。
[方案Ⅰ] 选用重量法进行测定:可用下图中的装置进行实验。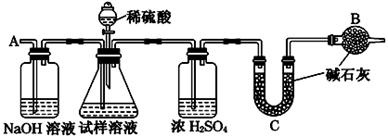
(1)A装置中NaOH溶液的作用是__________________若直接向试样溶液中鼓入空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)。
(2)该方案需直接测定的物理量是______________________________________。
[方案Ⅱ] 选用气体体积法进行测定:可用如图中的装置进行实验,为了减小实验误差,量气管中加入饱和NaHCO3溶液。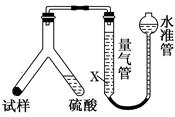
(3)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象
的原因可能是________。
a.测定气体体积时未冷却至室温
b.测定气体体积时水准管的液面高于量气管的液面
c.Y型管中留有反应生成的气体
d.气体进入量气管前未用浓硫酸干燥
[方案Ⅲ] 选用滴定法进行测定:
(4)称取m1g样品,配成100 mL溶液,取出20 mL,用c mol·L-1的标准HCl溶液滴定,消耗体积为VmL,则该试样中碳酸氢钠质量分数的计算表达式为:_________________。