体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2+O2 2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
2SO3,并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率
| A.等于p% | B.大于p% | C.小于p% | D.无法判断 |
有质量分数为a的氨水溶液,加入等质量的水稀释后,浓度从C1 mol•L﹣1成为C2mol•L﹣1,下列说法正确的是
| A.C1=2C2 | B.C1>2C2 | C.C1<2C2 | D.C1=a |
分类是化学研究中常用的方法。下列分类方法中,不正确的是
| A.依据分子中含有的氢原子的数目,将酸分为一元酸、二元酸等 |
| B.依据在水溶液中或熔融状态下能否导电,将化合物分为电解质和非电解质 |
| C.依据分散质粒子的大小,将分散系分为溶液、胶体、浊液 |
| D.依据组成的元素的种类,将纯净物分为单质和化合物 |
在无土裁培中,配制1L含0.5mol NH4Cl、0.16mol KCl、0.24mol K2SO4的某营养液,若用KCl、NH4Cl和(NH4)2SO4三种固体配制,则需此三种固体的物质的量分别为
| A.0.40mol 0.50mol 0.12mol |
| B.0.66mol 0.50mol 0.24mol |
| C.0.64mol 0.50mol 0.24mol |
| D.0.64mol 0.02mol 0.24mol |
如果a g某气体中含b 个分子,则c g该气体在标准状况下的体积是(NA为阿伏加德罗常数的值)
A. |
B.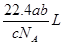 |
C. |
D. |
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是
| A.甲的分子数比乙的分子数多 |
| B.甲的物质的量比乙的物质的量少 |
| C.甲的摩尔体积比乙的摩尔体积小 |
| D.甲的相对分子质量比乙的相对分子质量小 |