根据下列实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结论 |
| A |
向稀硫酸与蔗糖共热后的溶液中滴加银氨溶液,水浴加热 |
无银镜产生 |
蔗糖未发生水解 |
| B |
溴乙烷与NaOH溶液共热后,加HNO3酸化呈酸性,加AgNO3溶液 |
出现淡黄色沉淀 |
溴乙烷发生了水解 |
| C |
向1 mL 1% NaOH溶液加入2 mL 2%的CuSO4溶液,振荡后滴加0.5 mL葡萄糖溶液,加热 |
未出现红色沉淀 |
葡萄糖中不含有醛基 |
| D |
溴乙烷、乙醇及固体NaOH混合加热,产生的气态物质Y,直接通入酸性高锰酸钾溶液 |
酸性高锰酸钾溶液褪色 |
Y一定是纯净的乙烯 |
下列排列顺序不正确的是
| A.热稳定性:CH4> SiH4 >HF | B.原子半径:Na>Mg>O |
| C.酸性:HClO4>H2SO4>H3PO4 | D.非金属性:F>Cl>Br |
下列有关表达式中不正确的是
A.乙烯的结构式: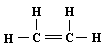 |
| B.乙烯的实验式:C2H4 |
| C.乙酸乙酯的分子式:C4H8O2 |
| D.乙酸的结构简式:CH3COOH |
下列有机物名称中,错误的是
| A.1,2—二溴乙烷 | B.2,3—二甲基丁烷 |
| C.2─丁烯 | D.2—甲基—3—乙基丁烷 |
目前,医疗上使用放射性核素 治疗肿瘤,该核素原子核内的中子数与电子数之差是
治疗肿瘤,该核素原子核内的中子数与电子数之差是
| A. 125 | B.72 | C.19 | D.53 |
笔、墨、纸、砚是文房四宝,做笔用的狼毫,研墨用的墨条以及宣纸(即白纸)和做砚台用的砚石的主要成份依次是
| A.蛋白质、炭黑、多糖、无机盐 | B.塑料、石墨、多糖、无机盐 |
| C.多糖、石墨、蛋白质、无机盐 | D.蛋白质、煤炭、多糖、有机玻璃 |