将0.1 mol N2和0.3 mol H2置于密闭容器中发生反应:N2+3H2 2NH3,下列关于该反应的说法中正确的是
2NH3,下列关于该反应的说法中正确的是
| A.增大压强,反应速率减小 |
| B.最终可生成0.2 mol NH3 |
| C.升髙温度,反应速率增大 |
| D.当V正(N2):V 正(H2)=1:3时,一定达化学平衡状态 |
常温下,下列溶液中各离子浓度关系正确的是
25℃时,向V mL pH=a的盐酸中,滴加p H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
H=b的NaOH溶液10V mL时,溶液中的Cl-和Na+的物质的量相等,则a+b的值是
| A.13 | B.14 | C.15 | D.不能确定 |
有等体积等pH的Ba(OH)2、NaOH和NH3·H2O三种碱溶液,滴加等浓度的盐酸将它们恰好中和,用去酸的体积分别为V1、V2、V3,则三者的大小关系正确的是
| A.V3>V2>V1 | B.V3=V2=V1 | C.V3>V2=V1 | D.V1=V2>V3 |
在密闭容器中发生反应:aX(g)+bY(g)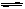 cZ(g)+dW(g),达到平衡后,
cZ(g)+dW(g),达到平衡后, 保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
保持温度不变,将气体压缩到原来的一半体积,当再次达到平衡时,W的浓度为原平衡的1.8倍。下列叙述不正确的是
| A.a+b>c+d | B.平衡向逆反应方向移动 |
| C.Z的体积分数减小 | D.X的转化率下降 |
如图所示为 条件一定时,反应2NO(g)+O2(g)
条件一定时,反应2NO(g)+O2(g)  2NO2(g) △H<0中NO的转化率与温度变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是
2NO2(g) △H<0中NO的转化率与温度变化关系曲线图,图中有a、b、c、d四个点,其中表示未达到平衡状态,且v正<v逆的点是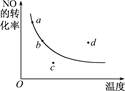
| A.a | B.b | C.c | D.d |