(12分)根据所学知识填空:
(1)已知某反应的各物质浓度数据如下:
aA(g) + bB(g)  2C(g)
2C(g)
起始浓度(mol·L-1): 1.5 1.0 0
2 s末浓度(mol·L-1): 0.9 0.8 0.4
则①a= ,b= ;
②2 s内用B表示该反应的反应速率为 。
(2)由碳棒、铁片和200 mL 1.5 mol·L-1的稀硫酸组成的原电池中,当在碳棒上产生气体3.36 L(标准状况)时,求:①有 个电子通过了电线?(NA=6.02×1023)
②此时溶液中H+的物质的量浓度为 (不考虑溶液体积变化)。
把6.5克锌放入足量的盐酸中,锌完全反应。计算
⑴6.5克锌的物质的量;
⑵参加反应的HCl的物质的量;
⑶生成H2的体积(标准状况)。
(1)中学教材上所示的NaCl晶体结构,它向三维空间延伸,得到完美晶体。NiO(氧化镍)晶体的结构与NaCl相同,Ni2+与最邻近O2-的核间距离为a×10-8cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g·mol-1)。
(2)天然的和绝大部分人工制备的晶体都存在各种缺陷,例如在某种NiO晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。其结果晶体仍呈电中性,但化合物中Ni和O的比值却发生了变化。其氧化镍样品组成为Ni0.97O,试计算该晶体中Ni2+与Ni3+的离子数之比。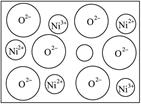
核内中子数为N的R2+离子,质量数为A,则它的n g氧化物中所含质子的物质的量是多少?
将0.1mol的镁铝混合物溶于100mL 2 mol·L-1的H2SO4中,然后再滴加1 mol·L-1的NaOH溶液。请回答:
(1) 若在滴加NaOH溶液的过程中,沉淀质量m随加入NaOH溶液的体积V的变化如图所示。当V1=160mL时,则金属粉末中,n(Mg)=?(要求写计算过程)
(2)若在滴加NaOH溶液的过程中,欲使Mg2+、Al3+刚好沉淀完全,则滴入NaOH溶液的体积V (NaOH)=_______mL?
某稀溶液中含4molKNO3和2.5molH2SO4,向其中加入1.5molFe粉,充分反应后产生的气体在标况下的体积为( )
| A.36L | B.28L | C.22.4L | D.11.2L |