接触法制硫酸工艺中,其主反应在450℃并有催化剂存在下进行:
2SO2 (g)+O2(g) 2SO3(g) +190kJ
2SO3(g) +190kJ
(1)下列描述中能说明上述反应已达平衡的是
| A.V (O2)正="2v" (SO3)逆 |
| B.容器中气体的平均分子量不随时间而变化 |
| C.容器中气体的密度不随时间而变化 |
| D.容器中气体的分子总数不随时间而变化 |
(2)在一个固定容积为5L的密闭容器中充入0.20 mol SO2和0.10molO2,半分钟后达到平衡,测得容器中含SO3 0.18mol,则V (O2) = mol.L-1.min-1:若继续通入0.20mol SO2和0.10mol O2,则平衡 移动(填“向正反应方向”“向逆反应方向” 或“不”),再次达到平衡后, mol<n(SO3)< mol。
图表法、图象法是常用的科学研究方法。
(1)短周期某主族元素M的电离能情况如图A所示。则M元素位于周期表的第族。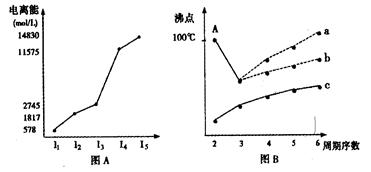
(2)图B是研究部分元素的氢化物的沸点变化规律的图像,折线c可以表达出第
族元素氢化物的沸点的变化规律。不同同学对某主族元素氢化物的沸点的变化趋势画出了两条折线——折线a和折线b,你认为正确的是:(填“a”或“b”)。
A、B、C、D、E、F是六种短周期主族元素,它们的原子序数依次增大,其中C、F分别是同一主族元素,A、F两种元素的原子核中质子数之和比C、D两种元素原子核中质子数之和少2,F元素的最外层电子数是次外层电子数的0.75倍。又知B元素的最外层电子数是内层电子数的2倍,E元素的最外层电子数等于其电子层数。请回答:根据元素的结构和有关性质可知,A、B、C、D、E、F分别是H、C、O、Na、Al、S。
(1)F元素在周期表中的位置为,B的最高价氧化物电子式为,E元素的价层电子排布式为。
(2)用B元素的单质与E元素的单质可以制成电极浸入由A、C、D三种元素组成化合物的溶液中构成电池,则电池负极反应式为。
(3)科学研究证明:化学反应热只与始终态有关,与过程无关。单质B的燃烧热为a kJ/mol。由B、C二种元素组成的化合物BC 14g完全燃烧放出热量b kJ,写出单质B和单质C反应生成BC的热化学方程式;
(4)1 mol由E、F二种元素组成的化合物跟由A、C、D三种元素组成的化合物反应生成两种盐和水,完全反应后消耗后者的物质的量为。
(13分)碳、氢、氧3种元素组成的有机物A,相对分子质量为102,含氢的质量分数为9.8%,分子中氢原子个数为氧的5倍。
(1)A的分子式是。
(2)A有2个不同的含氧官能团,其名称是。
(3)一定条件下,A与氢气反应生成B,B分子的结构可视为1个碳原子上连接2个甲基和另外2个结构相同的基团。
①A的结构简式是。
②A不能发生的反应是(填写序号字母)。
a.取代反应 b.消去反应 c.酯化反应 d.还原反应
(4)A还有另一种酯类同分异构体,该异构体在酸性条件下水解,生成两种相对分子质量相同的化合物,其中一种的分子中有2个甲基,此反应的化学方程式是。
(5)已知环氧氯丙烷可与乙二醇发生如下聚合反应: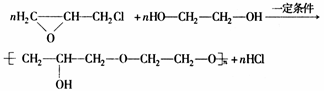
B也能与环氧氯丙烷发生类似反应生成高聚物,该高聚物的结构简式是。
醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1—溴丁烷的反应如下:
NaBr+H2SO4 HBr+NaHSO4①
HBr+NaHSO4①
R—OH+HBr R—Br+H2O②
R—Br+H2O②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br— 被浓硫酸氧化为Br2等。有关数据列表如下;
| 乙醇 |
溴乙烷 |
正丁醇 |
1—溴丁烷 |
|
| 密度/g·cm-3 |
0.7893 |
1.4604 |
0.8098 |
1.2758 |
| 沸点/℃ |
78.5 |
38.4 |
117.2 |
101.6 |
请回答下列问题:
(1)溴代烃的水溶性醇(填“大于”、“等于”或“小于”);其原因是
。
(2)将1—溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在()
(填“上层”、“下层”或“不分层”)。
(3)制备操作中,加入的浓硫酸必需进行稀释,起目的是()
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(4)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是()
a.NaI b.NaOH c.NaHSO3 d.KCl
(5)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于;但在制备1—溴丁烷时却不能边反应边蒸出产物,其原因是。
工业上以乙烯为原料,合成化学式为C3H6O3的化合物。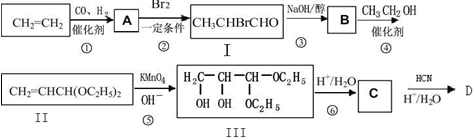
已知: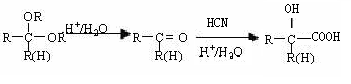
请回答相关的问题:
(1)写出下列物质的结构简式:A: C:
(2)写出反应③的化学方程式。
(3)D在浓硫酸存在条件下加热,可生成五原子环状化合物E(C4H6O4),请写出反应的化学方程式
(4)下列说法正确的是()
| A.化合物II 的分子式C5H9O2 |
| B.反应④的目的是防止—CHO在第⑤步被氧化 |
| C.反应③是消去反应,反应④是酯化反应 |
| D.化合物D 可以发生缩聚反应得到高分子化合物 |
(5)化合物F与C互为同分异构体,且化合物F满足以下条件
①取等物质的量F 分别与NaHCO3、Na 充分反应产生CO2和H2比为1:1
②化合物F符合下面的核磁共振氢谱图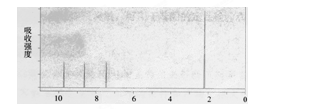
化合物F的结构简式为