烯烃A在一定条件下可以按下面的框图进行反应.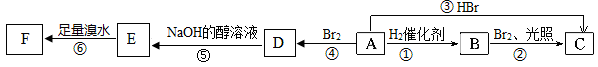
已知:D的结构简式为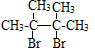 ,请完成填空:
,请完成填空:
(1)A的结构简式是:____________.
(2)框图中属于取代反应的是:________(填数字代号).
(3)C的结构简式是____________.
(4)写出由D→E的化学方程式____________________________________________
下表为元素周期表的一部分,a、b、c…为部分元素。回答下列问题:
| a |
|||||||||||||||||
| f |
y |
h |
i |
||||||||||||||
| b |
e |
j |
|||||||||||||||
| c |
d |
d |
g |
l |
|||||||||||||
(1)请写出上述元素d3+的核外电子排布式;
(2)请写出e元素的原子价电子轨道表示式;
(3)ya3分子的电子式是,其分子的空间构型是,
(4)b、e两种元素中,金属性较强的是 ;第一电离能大的是_______.(填元素符号)
(5)h的i形成hi2分子杂化类型是________ fh3-的空间构型分别为_______________
Co(NH3)5BrSO4可形成两种钴的配合物,结构分别为[Co(NH3)5Br] SO4和[Co (SO4) (NH3)5] Br已知Co3+的配位数是6,为确定钴的配合物的结构,现对两种配合物进行如下实验:在第一种配合物的溶液中加BaCl2溶液时,产生白色沉淀,在第二种配合物溶液中加入BaCl2溶液时,则无明显现象,则第一种配合物的结构为 __,第二种配合物的结构式为________;如果在第二种配合物溶液中滴加AgNO3溶液时,产生 _______ 现象。
在①HF、②H2S、③BF3、④CS2、⑤CCl4、⑥N2、⑦SO2分子中:
(1)以非极性键结合的非极性分子是___________
(2)以极性键相结合,具有直线型结构的非极性分子是___________
(3)以极性键相结合,具有正四面体结构的非极性分子是___________
(4)以极性键相结合,而且分子极性最大的是___________
某同学设计了如下实验,以测定CaCO3、(NH4)2CO3和NH4Cl固体混合物中氮元素的质量分数。实验过程如下图所示:
请回答:
(1)为进行操作①、②,需要用到的玻璃仪器有_____________________。
(2)原样品中氮元素的质量分数为_________________(用含W、m的代数式表示)。
(3)若该同学由于操作不当而使测定结果偏低,其原因可能是_________(填字母)。
a. 试剂①用量不足b. 固体未经洗涤
c. 试剂②用量不足 d. 气体C未经干燥
某化学兴趣小组设计了乙醇氧化以及检验其产物的实验装置图(图中酒精灯、铁架台、铁夹等均未画出)。装置A中为无水乙醇,装置E中为新制Cu(OH)2悬浊液。
请回答:
(1)在实验过程中,需要加热的装置有(填装置序号)。
(2)装置B中发生反应的化学方程式是;
能验证B中反应产物的实验现象是。
(3)装置D中碱石灰的作用是。