(1)在1—18号元素中,能形成最稳定气态氢化物的元素是 ;与水或酸反应最剧烈的金属单质是 ;最高价氧化物的水化物中碱性最强的元素是 ;最高价氧化物的水化物中酸性最强的元素是 。(填写元素符号)
(2)物质在下列变化过程中克服的是:a分子间作用力 b共价键 c离子键(填序号)
①冰融化 ;
②食盐熔化 ;
③H2S受热分解成S和H2 ;
④NaHSO4溶解于水 ;
(3)共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中,只含有上述一种作用的是_________
| A.干冰 | B.氯化钠 | C.氢氧化钠 | D.碘 |
(4)氮化钠是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答,Na3N的电子式是________, Na3N与盐酸反应方程式_____________________________________;
| A |
B |
C |
D |
E |
F |
G |
|
| A |
— |
— |
— |
— |
— |
— |
↓ |
| B |
— |
— |
— |
— |
↓ |
↓ |
↓ |
| C |
— |
— |
— |
↓ |
— |
↓ |
↓ |
| D |
— |
— |
↓ |
— |
↓ |
↓ |
↓ |
| E |
— |
↓ |
— |
↓ |
— |
↓ |
— |
| F |
— |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
| G |
↓ |
↓ |
↓ |
↓ |
— |
↓ |
— |
有A、B、C、D、E、F、G7瓶不同物质的溶液,它们各是Na2CO3、Na2SO4、KCl、AgNO3、MgCl2、Ca(NO3)2和Ba(OH)2溶液中的一种。为了鉴别,各取少量溶液进行两两混合,实验结果如下表所示。表中“↓”表示生成沉淀或微溶化合物,“—”表示观察不到明显变化。试回答下面问题:
(1)A的化学式是_________,G的化学式是_________,判断理由是____________________。
(2)写出其余几种物质的化学式:B:______________,C:______________,D:______________,E:______________,F:______________。
向橙色的溴水中撒入足量的镁粉,充分振荡后过滤,溶液呈现___________色,原因是______________________。若向滤液中加入适量的氯水后,溶液呈___________色,原因用离子方程式表示为_________________________。
若向此滤液中加入适量的硝酸银溶液,溶液中有___________生成,原因用离子方程式可表示为_________________________________。
(8分)硫酸是许多化学工业的原料,其消费量可作用一个国家工业发展水平的一种标志。硫酸工厂厂址的选择是一个复杂的问题,下图是影响化工厂选址的部分因素。又已知硫酸是一种腐蚀性液体,不便较多贮存,需随产随销。另外,硫酸的运输价格也比较贵,据估算1t H2SO4的运价约为同质量黄铁矿石的三倍。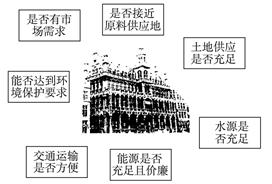
据以上信息,分析下列条件:
条件(Ⅰ)
①A城市郊区有丰富的黄铁矿资源,水源、能源充足,交通方便。
②A城市需使用硫酸的工业不多,而离它远的B城市却是一个消耗硫酸甚多的工业城市。
③A城市是一个风光秀丽的旅游城市,对环境保护的要求甚高,而且土地价格较贵,土地供应紧张。
条件(Ⅱ)
①C地是重要的农业区,需消耗大量的肥料。
②C地有丰富的磷灰石矿藏,水源、能源充足,土地价格较低,土地供应充足,交通方便。
③磷肥是由磷灰石〔有效成分是Ca3(PO4)2〕与H2SO4作用制得的,制造磷肥需消耗大量的硫酸。
④C地无磷肥厂和硫酸厂,在相邻的D地有丰富的黄铁矿资源。
在A、B、C、D四城市中,你认为应该建设硫酸工厂的城市是______________,应该建造磷肥厂的城市是______________。
合成氨工业中,原料气(N2、H2及少量CO、NH3的混合气)在进入合成塔前常用醋酸二氨合铜(I)溶液来吸收原料气中的CO,其反应式:
[Cu(NH3)2Ac]+CO+NH3 [Cu(NH3)3]Ac·CO ΔH<0。
[Cu(NH3)3]Ac·CO ΔH<0。
(1)必须除去原料气中CO的原因是_______________________________________。
(2)醋酸二氨合铜(I)吸收CO的生产适宜条件应是________________________。
(3)吸收CO后的醋酸铜氨溶液经过适当处理又可再生,恢复其吸收CO的能力以供循环使用。醋酸铜氨溶液再生的适宜条件应是___________________________________________。
已知:N2(g)+3H2(g) 2NH3(g) ΔH<0;2SO2(g)+O2(g)
2NH3(g) ΔH<0;2SO2(g)+O2(g) 2SO3(g) ΔH<0;
2SO3(g) ΔH<0;
回答下列问题:
(1)从影响速率和平衡的因素分析,要有利于NH3和SO3的生成,理论上应采取的措施是_________________。实际生产中采取的措施分别是__________________。
(2)在实际生产的合成氨过程中,要分离出氨气,目的是____________________________;而合成SO3过程中,不需要分离出SO3,原因是__________________。