化合物A是一种不稳定的物质,它的分子组成可用OxFy表示,10mLA气体能分解生成15mLO2和10mLF2(同温同压下)。则:
(1)我们可以通过计算确定A的化学式,其中x= ,y= ;
(2)已知A分子中x个氧原子呈…—O—O—O—…链状排列,则A分子的电子式是 ,结构式是 。
(1)在小烧杯中加入50ml沸水,滴入几滴饱和FeCl3溶液,煮沸至溶液呈红褐色,即制得Fe(OH)3胶体。
①写出该方法制备Fe(OH)3胶体的离子方程式_________________________________
②将其装入U形管内,用石墨作电极,接通直接电源,通电一段时间后发现阴极附近颜色________,这表明__________________________ __,这种
__,这种 现象称为________________。
现象称为________________。
③向其中逐滴加入2mol/L的稀硫酸至过量,现象是_______________________________;
原因是_____________________________________________________________________。
(2)下列事实不能用胶体的知识来解释的是______________________
A.用某些含铝的化合物作净水剂 B.医学上的血液透析
如图,A、B、C、D、E各代表碳、铁、二氧化碳、硫酸铜溶液、氢氧化钡溶液中的一种物质。一定条件下,相连环物质间能发生反应,不相连环物质间不能发生反应,且B的相对分子质量大于D。请填空: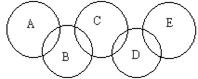
(1)写出下列物质的化学式:A ,B ,D 。
(2)写出下列反应的离子方程式:
B+C:,
(3)相连环物质间发生的反应中,氧化还原反应共有个。
有A、B、C、D四种无色溶液,它们分别是Na2CO3、Na2SO4、NaHSO4、BaCl2中的一种,为了确定各是何种溶液进行了下列实验,记录为:①A+D→溶液+气体,②B+C→溶液+沉淀,③B+A→溶液+沉淀X,④D+B→溶液Y+沉淀,⑤溶液Y+沉淀X→溶液+气体。
(1)根据以上记录确定:A___________________B____________________
C____________________D__________________(填化学式)
(2)写出①、⑤各反应的离子方程式:
①
⑤
(1)两个同容积的密封容器A、B,常温下,A中充入a g A气体,B中充入a g CH4气体,A与B内的压强之比是4∶11,则A的摩尔质量为_________________。
(2)某氯化镁溶液的密度为d g/cm3,其中镁离子的质量分数为w,a mL该溶液中Cl-
的物质的量为。
(3)标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ mL),所得溶液的密度为ρ g/ mL, 则该溶液的溶质的物质的量浓度为。
(4)在 11P + 15 CuSO4 +24 H2O =" 5" Cu3P +6 H3PO4 +15 H2SO4中,每 1 mol CuSO4可以氧化磷的物质的量是 __________ 。
氯碱工业中电解饱和食盐水的原理示意图,如图所示: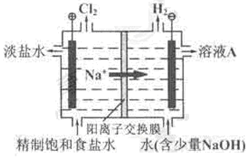
(1)溶液A的溶质是;
(2)电解饱和食盐水的离子方程式是;
(3)电解时用盐酸控制阳极区溶液的pH在2~3,用化学平衡移动原理解释盐酸的作用;
(4)电解所用的盐水需精制。
去除有影响的Ca2+、Mg2+、N H4+、SO42-[c(SO42-)>c(Ca2+)]。
H4+、SO42-[c(SO42-)>c(Ca2+)]。
精致流程如下(淡盐水和溶液A来电解池):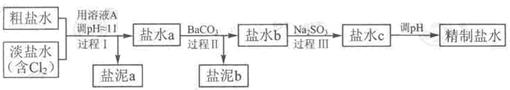
①盐泥a除泥沙外,还含有的物质是。
②过程Ⅰ中将NH4+转化为N2的离子方程式是
③BaSO4的溶解度比BaCO3的小,过程Ⅱ中除去的离子有
④经过程Ⅲ处理,要求盐水中c 中剩余Na2SO3的含量小于5mg /L,若盐水b中NaClO的含量是7.45 mg /L ,则处理10m3盐水b ,至多添加10% Na2SO3溶液kg(溶液体积变化忽略不计)。