(12分)针对下面10种元素,完成以下各小题。
| 周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
| 2 |
|
|
|
C |
N |
O |
|
Ne |
| 3 |
Na |
Mg |
Al |
Si |
|
S |
Cl |
|
(1)常温下,会在浓硫酸中发生钝化的金属是 (填名称)。
(2)化学性质最不活泼的元素是 (填元素符号)。
(3)镁的原子结构示意图为 。
(4)C与N相比,原子半径较小的是 。
(5)最高价氧化物对应的水化物酸性最强的是 碱性最强的是 (填化学式)。
(6)常用于制半导体材料的元素是 。
(7)H2S和HCl相比,热稳定性较强的是 。
(8)硫的一种氧化物可使品红溶液褪色,写出该氧化物的化学式 ,其中硫元素和氧元素的质量比m(S): m(O)= 。
(9)常温下金属钠能与水激烈反应,请写出反应的化学方程式:
现有几种物质的熔点数据如下表:
| A组 |
B组 |
C组 |
D组 |
| 金刚石:3 550℃ |
Li:181℃ |
HF:-83℃ |
NaCl:801℃ |
| 硅晶体:1 410℃ |
Na:98℃ |
HCl:-115℃ |
KCl:776℃ |
| 硼晶体:2 300℃ |
K:64℃ |
HBr:-89℃ |
RbCl:718℃ |
| 二氧化硅1 723℃ |
Rb:39℃ |
HI:-51℃ |
CsCl:645℃ |
据此完成下列问题:
(1)A组属于_______________晶体,其熔化时克服的粒子间的作用力是_______________。
(2)B组晶体共同的物理性质是_______________ (填序号)。
①有金属光泽 ②导电性 ③导热性 ④延展性
(3)C组中HF熔点反常是由于______________________________。
(4)D组晶体可能具有的性质是_______________ (填序号)。
①硬度小 ②水溶液能导电 ③固体能导电 ④熔融状态能导电
(5)XY晶体的单元结构如下图所示,晶体中距离最近的X+与Y-的核间距离为a cm,已知阿伏加德罗常数为Na mol-1,其密度为ρ g·cm-3,则XY的摩尔质量可表示为________ g·mol-1。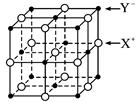
白磷分子中P—P键易断开,若一个白磷分子中每个P—P键断开插入一个氧原子,则一共可结合____________个氧原子,这样得到磷的一种氧化物,其分子式为________________。
1)图3-16为干冰的晶胞结构,观察图形,确定在干冰中每个CO2分子周围有__________个与之紧邻且等距离的CO2分子。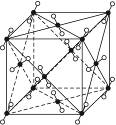
图3-16
在干冰中撒入镁粉,用红热的铁棒引燃后,再盖上另一块干冰,出现的现象为___________
_________,反应的化学方程式是______________________________。
(2)下列三种晶体①CO2 ②CS2 ③SiO2的熔点由高到低的顺序是__________>__________>__________(用序号填空),其原因是______________________________。
甲、乙、丙、丁为前三周期元素形成的粒子,它们的电子总数相等。已知甲、乙、丙为双原子分子或负二价双原子阴离子,丁为原子。
(1)丙与钙离子组成的离子化合物跟水反应产生一种可燃性气体,反应的化学方程式是______________________________。
(2)乙在高温时是一种还原剂,请用化学方程式表示它在工业上的一种重要用途:
________________________________________。
(3)在一定条件下,甲与O2反应的化学方程式是______________________________。
(4)丁的元素符号是__________,它的原子结构示意图为__________。
(5)丁的氧化物的晶体结构与__________的晶体结构相似。
1)构成分子晶体的粒子是__________,这类粒子间的作用力一定有__________,还可能有__________。如果分子间作用力只是__________,若以一个分子为中心,其周围通常可以有__________个紧邻的分子,分子晶体的这一特征称为__________。干冰中CO2分子采取的就是这样的堆积方式。若分子内存在吸引电子能力较强、半径较小的__________原子与H原子所形成的共价键,则会形成氢键,氢键不仅具有饱和性,也具有__________。能形成氢键的物质较多,如______________________________等。在冰中,每个水分子与相邻的__________个水分子形成氢键,呈__________立体结构。
(2)在原子晶体中,所有原子都以__________键结合,整个原子晶体是一个三维的__________结构。在金刚石中,C原子采取__________杂化方式,每个C原子与另外__________个C原子以共价键相结合,键角为__________,晶体中最小碳环由__________个C原子构成,且不在同一个平面内。晶体硅的结构与金刚石类似,SiO2的晶体结构可以看作是在晶体硅的Si—Si键之间插入__________原子而形成的,在12 g SiO2晶体中含有化学键的物质的量为 __________mol。