已知充分燃烧a g 乙炔气体时生成1mol二氧化碳气体和液态水,并放出热量bkJ,则乙炔燃烧的热化学方程式正确的是
| A.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H=-4b kJ/mol |
| B.C2H2(g) + 5/2O2(g) = 2CO2(g) + H2O(l) △H="2b" kJ/mol |
| C.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H=-2b kJ/mol |
| D.2C2H2(g) + 5O2(g) = 4CO2(g) + 2H2O(l) △H="b" kJ/mol |
核糖是合成核酸的重要原料,结构简式为CH2OH—CHOH—CHOH—CHOH—CHO。下列关于核糖的叙述正确的是
| A.与葡萄糖互为同分异构体 |
| B.可以与银氨溶液作用形成银镜 |
| C.可以跟氯化铁溶液作用显色 |
| D.可以使紫色石蕊试液变红 |
化学与生产、生活密切相关,下列有关说法正确的是
| A.生物柴油是不同酯组成的混合物,可用“地沟油”制得 |
| B.合成纤维、人造纤维及碳纤维都属于有机高分子材料 |
| C.纤维素在人体内可水解为葡萄糖,故可做人类的营养物质 |
| D.聚乙烯塑料制品可用于食品的包装,该塑料的老化是由于发生了加成反应 |
下列说法正确的是
| A.乙烯和聚乙烯均能使溴水褪色 |
| B.甲烷、苯和油脂均不能使酸性KMnO4溶液褪色 |
| C.乙酸和乙酸乙酯均能发生取代反应 |
| D.葡萄糖与果糖、淀粉与纤维素分子式相同,均互为同分异构体 |
根据转化关系判断下列说法正确的是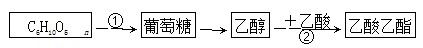
| A.(C6H10O5)n可以是淀粉或纤维素,二者均属于多糖,互为同分异构体 |
| B.可以利用银镜反应证明反应①的最终产物为葡萄糖 |
| C.酸性高锰酸钾可将乙醇氧化为乙酸,将烧黑的铜丝趁热插入乙醇中也可得到乙酸 |
| D.在反应②得到的混合物中倒入饱和氢氧化钠溶液并分液可得到纯净的乙酸乙酯 |
化学与科学、技术、社会、环境密切相关。下列有关说法中错误的是
| A.福岛核电站泄漏的放射性物质131I和127I互为同位素,化学性质几乎相同 |
| B.大量燃烧化石燃料排放的废气中含有大量SO2,造成大气污染,从而使雨水的pH=5.6,形成酸雨 |
| C.大量排放NO和NO2等氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D.高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |