已知一定温度时:N2(g)+3 H2(g) 2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q。则下列关系式中正确的是
2NH3(g)。当生成2molNH3时,放出热量为92kJ,在相同温度和压强下,向密闭容器中通入1mol N2和3mol H2,达到平衡时放出热量为Q。则下列关系式中正确的是
| A.Q=92 kJ | B.Q< 92 kJ | C.Q> 92 kJ | D.Q=194kJ |
下列关于水的说法正确的是
| A.我们平时应多饮用很纯净的水,防止有毒物质进入体内 |
| B.所有的天然水都不能饮用 |
| C.人体内含有约2/3体重的水,故人每天不用喝水也可以 |
| D.人类可利用的水只占自然界水的极少量,我们应节约用水 |
长期吸食或注射毒品会危及人体健康,下列各组中都属于毒品的是
| A.冰毒、黄连素 | B.海洛因、青霉素 | C.大麻、摇头丸 | D.黄曲霉素、尼古丁 |
2009年3月22日是第17届世界水日(World Water Day)。自来水生产中通常使用少量氯气进行杀菌消毒,氯气与水反应的产物之一是盐酸。市场上有些不法商贩为牟取暴利,用自来水冒充纯净水(蒸馏水)出售。为辨别真伪,可用下列一种化学试剂来鉴别,该试剂是
| A.酚酞试液 | B.氯化钡溶液 | C.氢氧化钠溶液 | D.硝酸银溶液 |
具有解热镇痛作用的药物“芬必得”,其主要成分的结构简式如下图: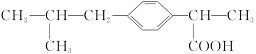
它属于
| A.甲酸的同系物 | B.芳香族化合物 |
| C.易溶于水的有机物 | D.易升华的物质 |
从毒韭菜到炸鸡翅、从速溶茶到婴幼儿奶粉,关于食品质量的报道中不断有①“致癌农药”;②“三聚氰胺”;③“碘元素”;④“亚硝酸盐”等化学名词出现。上述化学名词所提到的物质中,可以作为食品添加剂且符合限量时不会引起中毒的是
| A.②③④ | B.②③ | C.③④ | D.只有③ |