设NA表示阿伏加德罗常数的值,下列叙述正确的是
| A.60g丙醇存在的共价键总数为10 NA |
| B.常温常压下,28 g C2H4和CO的混合气体中含有碳原子的数目为1.5NA |
| C.7.2g新戊烷与异戊烷的混合物中所含极性共价键的数目为1.2NA |
| D.标准状况下,11.2 L乙醇中含有的碳氢键数为2.5NA |
向100mL0.1mol·L-1硫酸亚铁铵[(NH4)2Fe(SO4)2]溶液中逐滴滴入0.1mol·L-1Ba(OH)2溶液。随着Ba(OH)2溶液体积V的变化,沉淀总物质的量n的变化如下图所示。则下列说法中正确的是
| A.a点时溶液中所含主要溶质为(NH4)2SO4 |
| B.a→b段发生反应的离子方程式是: SO42-+Ba2+===BaSO4↓ |
| C.b点为最大沉淀量,对应的纵坐标值为0.02 |
| D.c点加入Ba(OH)2溶液的体积为200 mL |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只能被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是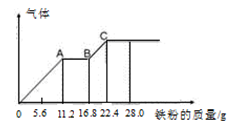
| A.混合酸液中NO3-的物质的量为0.4mol |
| B.OA段产生是NO,AB段反应为 2Fe3++Fe = 3Fe2+,BC段产生氢气 |
| C.溶液中最终溶质为FeSO4 |
| D.c(H2SO4)为5 mol·L-1 |
在1200℃时,天然气脱硫工艺中会发生下列反应:
H2S(g)+ O2(g)═SO2(g)+H2O(g) △H1
O2(g)═SO2(g)+H2O(g) △H1
2H2S(g)+SO2(g)═ S2(g)+2H2O(g) △H2
S2(g)+2H2O(g) △H2
H2S(g)+ O2(g)═S(g)+H2O(g) △H3
O2(g)═S(g)+H2O(g) △H3
2S(g)═S2(g)△H4 则△H4的正确表达式为
A.△H4=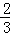 (△H1+△H2﹣3△H3) (△H1+△H2﹣3△H3) |
B.△H4=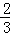 (3△H3﹣△H1﹣△H2) (3△H3﹣△H1﹣△H2) |
C.△H4= (△H1+△H2﹣3△H3) (△H1+△H2﹣3△H3) |
D.△H4= (△H1﹣△H2﹣3△H3) (△H1﹣△H2﹣3△H3) |
将一定质量的铁、氧化铁、氧化铜的混合物粉末放入100 mL 4.40 mol·L-1盐酸中,充分反应后产生896 mL H2(标准状况),残留固体1.28 g。过滤,滤液中无Cu2+。将滤液加水稀释到200 mL,测得其中c(H+)为0.400 mol·L-1。则原混合物中单质铁的质量是
| A.2.24 g | B.3.36 g | C.5.60 g | D.10.08 g |
镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M = NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH-=" 6" Ni(OH)2 + NO2- 下列说法正确的是:
| A.充电过程中OH- 离子从阳极向阴极迁移 |
| B.充电过程中阴极的电极反应式:H2O + M + e-=" MH" + OH-,H2O中的H被M还原 |
| C.电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |