镍氢电池(NiMH)目前已经成为混合动力汽车的一种主要电池类型。NiMH中的M表示储氢金属或合金。该电池在充电过程中的总反应方程式是:Ni(OH)2 + M = NiOOH + MH
已知:6NiOOH + NH3 + H2O + OH-=" 6" Ni(OH)2 + NO2- 下列说法正确的是:
| A.充电过程中OH- 离子从阳极向阴极迁移 |
| B.充电过程中阴极的电极反应式:H2O + M + e-=" MH" + OH-,H2O中的H被M还原 |
| C.电池放电过程中,正极电极反应式为:NiOOH + H2O + e-= Ni(OH)2 + OH- |
| D.NiMH电池中可以用KOH溶液、氨水等作为电解质溶液 |
“化学,我们的生活,我们的未来”是2011年“国际化学年”的主题。下列行为中不符合这一主题的是()
| A.控制含磷洗涤剂的生产和使用,防止水体富营养化,保护水资源 |
| B.研究采煤、采油新技术,尽量提高产量以满足工业生产的快速发展 |
| C.开发太阳能、水能、风能等新能源,减少使用煤、石油等化石燃料 |
| D.实现资源的“3R”利用,即减少资源消耗(Reduce)、增加资源的重复使用(Reuse)、提高资源的循环利用(Recycle) |
下列说法正确的是()
| A.(NH4)2SO4溶液能使蛋白质变性 |
| B.分子式为C2H4O2的有机物不一定是羧酸 |
| C.煤的干馏是物理变化,煤的气化和液化是化学变化 |
| D.纤维素、蛋白质、油脂、葡萄糖在一定条件下都能发生水解反应 |
电导率可用于衡量电解质溶液导电能力大小。室温下,用0.100 滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
滴定 10.00 mL 浓度均为 0.100 mol/L HCl和CH3COOH的混合溶液,所得曲线如右图所示。下列说法正确的是()
A.①点溶液中C(H+)为 |
| B.溶液温度高低为①〉③〉② |
C.③点溶液中有 |
| D.③点后因离子数目减少使溶液电导率略降低 |
潜艇上的核反应堆使用液态铝钠合金(单质钠和单质铝熔合而成)作载热介质,下列有关说法正确的是()
| A.该合金的熔点介于钠、铝之间 |
| B.钠或铝形成的氧化物均为碱性氧化物 |
| C.钠和铝分别与不足量的盐酸反应所得溶液均呈中性 |
| D.若合金中《(Na)>«(Al),将其投入到足量的水中可得无色透明溶液 |
锂钒氧化物凝胶电池能量密度高,成本低,便于大量推广。电池总反应式为: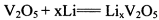 ,该电池放电时的有关说法正确的是()
,该电池放电时的有关说法正确的是()
| A.负极发生氧化反应,电极材料为V2O5 |
| B.锂离子在凝胶中向负极移动 |
C.正极的电极反应式为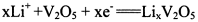 |
| D.该电池的凝胶介质也可用KOH溶液代替 |