Ⅰ.充分燃烧1.4 g某有机物A生成4.4 gCO2和1.8 g H2O,该有机物蒸气的密度是相同条件下H2密度的28倍。
(1)该有机物的分子式为________。
(2)A的链状同分异构体共________种。
(3)A的链状同分异构体中含有支链的同分异构体的结构简式为________,其系统命名为________。
(4)B是A的某种同分异构体,B的磁共振氢谱中只有4个信号峰(即只有4种氢原子),B通入Br2的CCl4溶液褪色,生成化合物C。则由B生成C的化学方程式为________。
Ⅱ.油脂是高级脂肪酸甘油酯,在工业上用途广泛。
(1)以硬脂酸甘油酯为例写出油脂的皂化反应方程式为
(2)从皂化反应后的溶液中提取肥皂和甘油的过程如下:
加入食盐颗粒后,液体表面析出白色固体,则食盐的作用是 。
用一定量的废铜制取胆矾有两种方法:第一种是取铜与浓H2SO4直接反应,化学反应方程式是;第二种是先将铜在空气中加热使之生成CuO,再与稀H2SO4反应。其中第种方法好,原因是。
(8分)用下面的原子或离子结构示意图的编号(A、B、C、D)填空: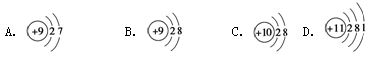
(1)核外电子层排布相同的是__________和___________;
(2)属于同种元素的是__________和__________;
(3)属于金属元素的是____________________;
(4)写出D参加化学反应后所得离子的结构示意图_______。
(16分,每空2分)
Ⅰ.某课外活动小组为了检验浓硫酸与木炭在加热条件下反应产生的SO2和CO2气体,设计了如图所示实验装置,a、b、c为止水夹,B是用于储气的气囊,D中放有用I2和淀粉的蓝色溶液浸湿的脱脂棉。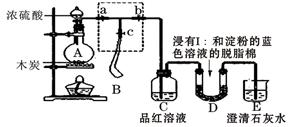
请回答下列问题
(1)对于易燃、易爆、有毒的化学物质,往往会在其包装上面贴上危险警告标签。浓硫酸的危险警告标签是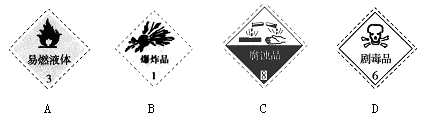
(2)装置A中发生反应的化学方程式为___________________________________。
(3)此实验成败的关键在于控制反应产生气体的速率不能过快,因此设计了虚框部分的装置,则正确的操作顺序是_________________(用操作编号填写)
①向A装置中加入浓硫酸,加热,使A中产生的气体进入气囊B,当气囊中充入一定量气体时,停止加热;
②待装置A冷却,且气囊B的体积不再变化后,关闭止水夹a,打开止水夹b,慢慢挤压气囊,使气囊B中气体慢慢进入装置C中,待达到实验目的后,关闭止水夹b;
③打开止水夹a和c,关闭止水夹b;
(4)实验时,装置C中的现象为_______________________________________;
(5)当D中产生_________________现象时,可以说明使E中澄清石灰水变浑浊的是CO2,而不是SO2;
(6)若为检验浓硫酸与木炭在加热条件下生成的水蒸汽,可在装置___________________之间加上一个盛有无水CuSO4的硬质玻璃管。
Ⅱ.Cu与浓硫酸反应可得硫酸铜溶液。某学习小组将铜屑放入一定浓度的硫酸中,加热并不断鼓入空气也可得硫酸铜溶液,其反应原理为2Cu+O2+2H2SO4="=" 2CuSO4+2H2O。现欲将12.8g铜完全溶解,加蒸馏水后得200 mL溶液。计算:
(7)参加反应的氧气在标准状况下的体积是___________________L。
(8)所得硫酸铜溶液的物质的量浓度是__________________mol/L。
(10分 每空2分)如图为实验室某浓盐酸试剂瓶标签上的有关数据,试根据标签上的有关数据回答下列问题: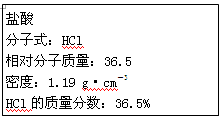
(1)该浓盐酸中HCl的物质的量浓度为__________mol·L-1。
(2)取用任意体积的该盐酸溶液时,下列物理量中不随所取体积的多少而变化的是_____。
A.溶液中HCl的物质的量 B.溶液的浓度
C.溶液的密度 D.溶液中Cl-的数目
(3)下列容量瓶的使用方法中,不正确的是____________
A.使用容量瓶前检验是否漏水
B.容量瓶用水洗净后,再用待配溶液洗涤
C.配制溶液时,如果试样是固体,把称好的固体用纸条小心倒入容量瓶中,缓慢加水至接近刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
D.配制溶液时,若试样是液体,用量筒取样后用玻璃棒引流倒入容量瓶中,缓慢加水至刻度线1~2cm处,用胶头滴管加蒸馏水至刻度线。
E.盖好瓶塞,用食指顶住瓶塞,另一只手托住瓶底,把容量瓶反复倒转多次,摇匀。
(4)某学生欲用上述浓盐酸和蒸馏水配制480mL物质的量浓度为0.200 mol·L-1的稀盐酸。
①该学生需要用量筒量取________mL上述浓盐酸进行配制。
②在配制过程中,下列实验操作会使所配制的稀盐酸的物质的量浓度偏大的有_____
A.转移溶液后未洗涤烧杯和玻璃棒就直接定容。
B.用量筒量取浓盐酸时俯视观察凹液面。
C.在容量瓶中定容时俯视刻度线。
D.定容后把容量瓶倒置摇匀,发现液面低于刻度线,又加水至刻度线。
Ⅰ.下列物质能导电的是;属于碱的是;属于电解质的是 ;(填编号)
①HCl气体、②Ca(OH)2固体、③KNO3固体、④SO2、⑤Cu、⑥NH3.H2O、
⑦KNO3溶液、⑧石墨、⑨蔗糖、⑩硫酸钡固体
Ⅱ.某化学反应的反应物和产物如下:
Al+NaNO3+H2O—Al(OH)3+N2↑+NaAlO2
a、该反应的氧化剂是.
b、该反应的氧化产物是.
c、反应过程中转移5mol电子,生成标准状况下N2的体积为L.