元素周期表中第VIIA族元素的单质及其化合物的用途广泛。
(1)与氯元素同族的短周期元素的原子结构示意图为 。
(2)能作为氯、溴、碘元素非金属性(原子得电子能力)递变规律的判断依据为 (填字母)。
| A.Cl2、Br2、I2的熔点 | B.Cl2、Br2、I2的氧化性 |
| C.HCl、HBr、HI的热稳定性 | D.HCl、HBr、HI的酸性 |
(3)一定条件,在水溶液中1 mol Cl-、ClOx-(x=1,2,3,4)的能量(KJ)相对大小如图所示。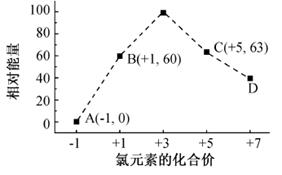
①D为 (填离子符号)。
②B→A+C反应的热化学方程式为 (用离子符号表示)。
(4)某化合物是一种不稳定的物质,其分子组成可用OxFy表示,10mLOxFy气体能分解生成15mLO2和10mLF2(同温同压)。
①该化合物的化学式为 。
②已知该化合物分子中x个氧原子呈…O—O—O…链状排列,则其电子式为 ,…O—O—O…链状排列中中间氧的价态为 。
某天然有机化合物
仅含
、
、
元素,与A相关的反应框图如下:
(1)写出下列反应的反应类型:
第①步反应、
、
第①步反应、
。
(2)
所含官能团的名称是。
(3)写出
、
、
、
的结构简式
:、
:、
:、
:。
(4)写出在浓
存在并加热的条件下,
与足量乙醇反应的化学方程式:
。
(5)写出与
具有相同官能团的D的所有同分异构体的结构简式:
。
难溶化合物的饱和溶液存在着溶解平衡,例如:
AgCl(s)  Ag++Cl—,Ag2CrO4(s)
Ag++Cl—,Ag2CrO4(s)  2Ag++CrO42—,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
2Ag++CrO42—,在一定温度下,难溶化合物饱和溶液离子浓度的乘积为一常数,这个常数用Ksp表示。
已知:Ksp(AgCl)=[Ag+][Cl-]=1.8×10-10
Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.9×10-12
现有0.001摩/升AgNO3溶液滴定0.001摩/升KCl和0.001摩/升的K2CrO4的混和溶液,试通过计算回答:
(1)Cl-和CrO42-中哪种先沉淀?
(2)当CrO42-以Ag2CrO4形式沉淀时,溶液中的Cl-离子浓度是多少? CrO42-与Cl-能否达到有效的分离?(设当一种离子开始沉淀时,另一种离子浓度小于10-5mol/L时,则认为可以达到有效分离)
10℃时加热NaHCO3饱和溶液,测得该溶液的pH发生如下变化:
| 温度(℃) |
10 |
20 |
30 |
加热煮沸后冷却到50℃ |
| pH |
8.3 |
8.4 |
8.5 |
8.8 |
甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为 。乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度 (填“大于”或“小于”)NaHCO3。丙同学认为甲、乙的判断都不充分。丙认为:
⑴只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则 (填“甲”或“乙”)判断正确。试剂X是 。
| A.Ba(OH)2溶液 | B.BaCl2溶液 | C.NaOH溶液 | D.澄清的石灰水 |
⑵将加热后的溶液冷却到10℃,若溶液的pH (填“高于”、“低于”或“等于”)8.3,则 (填“甲”或“乙”)判断正确。
⑶查阅资料,发现NaHCO3的分解温度为150℃,丙断言 (填“甲”或“乙”)判断是错误的,理由是 。
有人设计以Pt和Zn为电极材料,埋入人体内作为作为某种心脏病人的心脏起搏器的能源。它依靠跟人体内体液中含有一定浓度的溶解氧、H+和Zn2+进行工作,试写出该电池的两极反应式。
已知某无色透明的溶液中所含的离子仅有Na+、CH3COO-、H+和OH-四种离子,试回答下列问题:
⑴该溶液所含的四种离子的物质的量浓度大小之间的关系是否只有一种可能(填“是”或“否”),其原因是:。
⑵某学生将该溶液中的四种离子的物质的量浓度按从大到小的顺序排列了若干种可能,其中合理的是:
| A.c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | B.c(CH3COO-)=c(Na+)>c(OH-)=c(H+) |
| C.c(H+)>c(OH-)>c(Na+)>c(CH3COO-) | D.c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |