(9分)学习了元素周期表,可以帮助我们进一步丰富不同元素间的相互转化关系。已知A、B、C、D都处于短周期,A、D为单质,B、C是化合物。
(1)假设A、D元素处于同主族:
①当B是H2O时,化学方程式 ;
②当B、C均为氧化物时,化学方程式 ,其工业价值是 。
(2)假设A、 D不在同主族:
①当B是H2O且B是还原剂时,化学方程式 。
②当B是H2O且B是氧化剂时,化学方程式 。
氧化还原反应在生活中应用广泛,酸性KMnO4、H2O2、Fe(NO3)3是重要的氧化剂.用所学知识回答问题:
(1) 3H2SO4+2 KMnO4+5H2O2=K2SO4+2MnSO4+5 O2↑+8 H2O,当有6 mol H2SO4参加反应的过程中,有 mol还原剂被氧化。
(2)在稀硫酸中,KMnO4能将H2C2O4氧化为CO2。该反应的化学方程式为
。
(3)取300mL 0.2mol/L的KI溶液与一定量的酸性KMnO4溶液恰好反应,生成等物质的量的I2和KIO3,则消耗KMnO4的物质的量的是 mol。
(4)在Fe(NO3)3溶液中加入Na2SO3溶液,溶液先由棕黄色变为浅绿色,过一会又变为棕黄色,溶液先变为浅绿色的离子方程式是 ,又变为棕黄色的原因是 .
用于合成树脂的四溴双酚F、药物透过性材料高分子化合物PCL合成如下。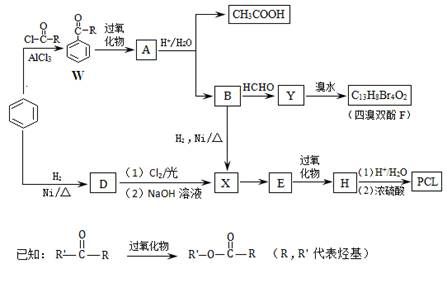
(1)W中—R是 。
(2)A的结构简式是_________。
(3)A生成B和CH3COOH的反应类型是_________。
(4)D→X过程中所引入的官能团分别是_________。
(5)有机物Y的苯环上只有2种不同化学环境的氢原子。
由Y生成四溴双酚F的反应方程式是________。
氯元素是生产生活中常见的非金属元素
(1)将Cl2通入NaOH溶液中得到以NaClO为有效成分的漂白液,写出该反应的离子方程式: 。
(2)使用Cl2为自来水消毒时,会与水中的有机物生成对人体有害的有机氯化物。下列物质中可以替代Cl2为自来水杀菌消毒的是 (填字母序号)。
a.臭氧 b.NH3 c.明矾 d.ClO2
(3)生物质混煤燃烧是当今能源燃烧利用的最佳方式之一,但生物质中氯含量较多,燃烧过程中会形成金属氯化物(如NaCl)和Cl2等物质,对金属炉壁造成腐蚀。
① NaCl和Cl2中化学键的类型分别是 和 。
② 燃煤过程中生成的SO2会与NaCl等物质发生反应,生成硫酸盐和Cl2。若生成Cl222.4 L(标况)时转移电子数为4×6.02×1023,该反应的化学方程式是 。
③ 已知:
2H2O2(l) ="==" 2H2O(l)+O2(g)ΔH1=-196.46 kJ·mol-1
H2(g)+1/2O2(g) ="==" H2O(l)ΔH2=-285.84 kJ·mol-1
Cl2(g)+H2(g) ="==" 2HCl(g)ΔH3=-184.60 kJ·mol-1
在催化剂作用下,用H2O2(l)可除去上述燃烧过程中产生的Cl2。依据上述已知反应,写出该反应的热化学方程式: 。
(4)工业上通过如下转化可制得KClO3晶体:
NaCl溶液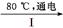 NaClO3溶液
NaClO3溶液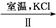 KClO3晶体
KClO3晶体
完成Ⅰ中电解过程中阳极的反应式: 。
(5)一定条件下,在水溶液中1 mol Cl-、ClO-x(x=1,2,3,4)的能量(kJ)相对大小如下图所示。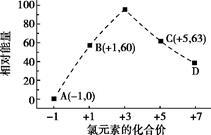
①D是 (填离子符号)。
②B A+C反应的热化学方程式为 (用离子符号表示)。
A+C反应的热化学方程式为 (用离子符号表示)。
(12分)某反应中反应物与生成物有:FeCl2、FeCl3、CuCl2、Cu。

(1)将上述反应设计成原电池如图甲所示,请回答下列问题:
①图中X溶液的溶质是____(填化学式),Cu电极上发生的电极反应方程式为 。
②原电池工作时,盐桥中的_____________ (填“K+”或“Cl-”)不断进入X溶液中。
(2)将上述反应设计成电解池如图乙所示,乙烧杯中金属阳离子的物质的量与电子转移的物质的量关系如图丙,请回答下列问题:
①M是直流电源的__________极;图丙中的②线是_________的物质的量的变化。
②当电子转移为2mol时,向乙烧杯中加入________ L5mol·L-1NaOH溶液,才能使溶液中所有的金属阳离子沉淀完全。
(3)铁的重要化合物高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂,具有很多优点。
①高铁酸钠生产方法之一是电解法,其原理为Fe+2NaOH+2H2O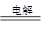 Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
Na2FeO4+3H2↑,则电解时阳极的电极反应方程式为__________________________________。
②高铁酸钠生产方法之二是在强碱性介质中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和水,该反应的离子方程式为___________________________________。
(9分)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。请回答: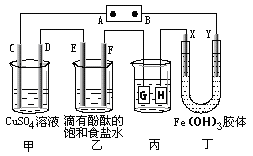
(1)B极是电源的 ,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 ,在电场作用下向Y极移动。
(2)若甲、乙装置中的C、D、E、F电极均只有一种单质生成时,对应单质的物质的量之比为 。
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”),电镀液是 溶液。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。