下列物质属于芳香烃,但不是苯的同系物的是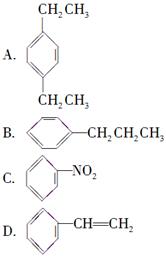
25℃时,用浓度为0.1000 mol/L的NaOH溶液滴定25.00 mL浓度均为0.1000 mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是
| A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ<HY<HX |
| B.根据滴定曲线,可得Ka(HY)=10—5 |
| C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时:c(X—)>c(Y—)>c(OH—)>c(H+) |
D.HY与HZ混合,达到平衡时: |
在容积相同的五个密闭容器中分别放入等量的A2和B2,在不同温度下同时任其发生反应:A2(g)+3B2(g)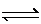 2AB3(g),分别在某一相同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
2AB3(g),分别在某一相同时刻测得其中AB3所占的体积分数变化如图所示,下列说法不正确的是
| A.正反应是放热反应 |
| B.E、F二点尚未达到平衡 |
| C.H、I二点尚未达到平衡 |
| D.G、H、I三点已达平衡状态 |
相同条件下,在①pH=2的CH3COOH溶液、②pH=2的HCl溶液、③pH=12的氨水、④pH=12的NaOH溶液中,下列说法不正确的是
| A.水电离的c(H+):①=②=③=④ |
| B.等体积的①、②分别与足量铝粉反应,生成H2的量:②>① |
| C.若将②、③溶液混合后,pH=7,则消耗溶液的体积:②>③ |
| D.将四种溶液分别稀释100倍后,溶液的pH:③>④>②>① |
下列各表述与示意图一致的是
| A.图①表示室温时,用0.1 mol.L-1盐酸滴定0.1 mol·L-1NaOH溶液过程中的pH变化 |
B.T℃时,反应2NO2(g) N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 N2O4(g)达到平衡时NO2的体积分数φ(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅 |
| C.图③表示向绝热恒容密闭容器中通入A2和B2,一定条件下使反应 2A2(g)+B2(g)  2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 2C(g)达到平衡,正反应速率随时间变化的示意图。由图可得出的结论是:反应物的总能量低于生成物的总量 |
D.图④在恒温恒容的密闭容器中,气体M存在如下关系xM(g) Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 Mx(g),t1时刻,保持温度不变,再充入1 mol M,重新达到平衡时 将增大 将增大 |
以NA代表阿伏加德罗常数,则关于反应:C2H2(g)+ 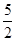 O2(g) =2CO2(g)+H2O(1);△H=-1300kJ/mol下列说法中,正确的是
O2(g) =2CO2(g)+H2O(1);△H=-1300kJ/mol下列说法中,正确的是
| A.有10NA个电子转移时,该反应吸收1300kJ的能量 |
| B.有NA个水分子生成且为液态时,吸收1300kJ的能量 |
| C.有NA个碳氧共用电子对形成时,放出1300kJ的能量 |
| D.有8NA个碳氧共用电子对形成时,放出1300kJ的能量 |