运用元素周期律分析下面的推断,其中错误的是
| A.锂(Li)的密度比钠小,锂的熔沸点也比钠低 |
| B.砹(At)为有色固体,AgAt难溶于水也不溶于稀硝酸 |
| C.在氧气中,铷(Rb)的燃烧产物比钠的燃烧产物更复杂 |
| D.HBrO4的酸性比HIO4的酸性强 |
下列说法正确的是
①植物油和裂化汽油都可以使溴水褪色;②葡萄糖、油脂和蛋白质都能发生水解反应;③按汽油、煤油、柴油的顺序,含碳量逐渐增加;④防腐剂福尔马林(含甲醛)可用作食品保鲜剂;⑤乙醇、乙酸、乙酸乙酯都能发生取代反应
| A.①③⑤ | B.①②⑤ | C.②④⑤ | D.②③④ |
取一小段镁带,用砂纸除去表面的氧化膜,放入试管中。向试管中加入2mL水,并滴入2滴酚酞试液。一会儿后发现镁带表面有气泡放出,且镁带附近溶液变红色。加热试管至水沸腾。发现镁带表面有大量气泡放出,且试管中的液体全部变为浅红色。关于该实验下列说法不正确的是
| A.温度越高,镁与水反应的速率越快 |
| B.镁与水反应的化学方程式为:Mg+2H2O ="==" Mg(OH)2+H2↑ |
| C.氢氧化镁显碱性,且在水中有一定的溶解性 |
D.氢氧化镁是离子化合物,它的电子式可表示为: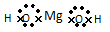 |
海水开发利用的部分过程如图所示。下列说法错误的是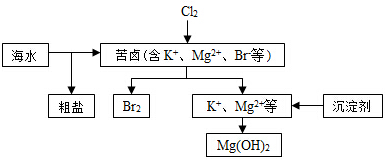
| A.向苦卤中通入Cl2是为了提取溴 |
| B.工业生产中常选用NaOH作为沉淀剂 |
| C.粗盐可采用除杂和重结晶等过程提纯 |
D.富集溴一般先用空气和水蒸气吹出单质溴,再用 将其还原吸收 将其还原吸收 |
下列有关性质的比较,不能用元素周期律解释的是
| A.酸性:H2SO4>H3PO4 | B.非金属性:Cl>Br |
| C.碱性:NaOH>Mg(OH)2 | D.热稳定性:Na2CO3>NaHCO3 |
下列有关化学用语的使用不正确的是
A.乙烯的比例模型: |
B.3,3-二甲基戊烷的键线式: |
C.对甲基苯甲醇的结构简式: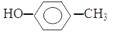 |
| D.醛基的结构简式:—CHO |