某金属粉末的混合物11 g,加入到足量的稀H2SO4中,标准状况下产生的气体体积为11.2 L,则此混合物可能是()
| A.Al和Mg | B.Al和Zn |
| C.Zn和Fe | D.Mg和Zn |
由下列一组物理量就可以估算出气体中分子间平均距离的是()
| A.阿伏加德罗常数、该气体的摩尔质量和质量 |
| B.阿伏加德罗常数、该气体的摩尔质量和密度 |
| C.阿伏加德罗常数、该气体的质量和体积 |
| D.该气体的体积和摩尔质量 |
在标准状况下,氧气的密度为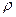 g·L
g·L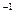 ,则氢气的密度为()。
,则氢气的密度为()。
A.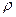 g·L g·L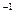 |
B.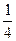 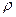 g·L g·L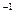 |
C.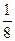 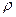 g·L g·L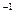 |
D.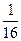 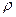 g·L g·L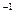 |
我们已经知道:当气体分子的物质的量相同时,气体分子数相同。影响物质体积大小的因素有:构成物质的粒子大小、粒子个数、粒子间距,在不同条件下,它们对体积影响的程度会有所不同。试判断,如果4 g氨气含x个分子,那么8 g硫化氢中含有的分子数为 …
()
A.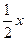 |
B.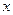 |
C.2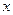 |
D.4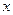 |
在相同温度下,相同质量的下列气体分别通入相同容积的密闭容器中,容器内的压强最小的是()
| A.二氧化硫 | B.氯气 | C.氢气 | D.二氧化碳 |