同周期的X、Y、Z三种元素,已知其高价氧化物对应的水化物的酸性强弱顺序是: HXO4>H2YO4>H3ZO4,则下列各判断中正确的是
| A.原子半径:X>Y>Z | B.单质的非金属性:X<Y<Z |
| C.气态氢化物稳定性:X<Y<Z | D.原子序数:X>Y>Z |
使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与足量氯气在光照的条件下发生取代反应,则两个过程中消耗的氯气的总的物质的量是()
| A.3mol | B.4mol | C.5mol | D.6mol |
下列有机反应的产物中不可能存在同分异构体的是( )
| A.CH3CH===CH2与HCl加成 |
| B.CH3CH2CH2Cl在碱性溶液中水解 |
| C.CH2===CH—CH===CH2与H2按物质的量之比为1﹕1进行反应 |
D. 与NaOH的醇溶液共热 与NaOH的醇溶液共热 |
下列说法错误的是( )
| A.蒸馏时应调整温度计的水银球于蒸馏烧瓶支管口附近 |
| B.提纯液体混合物常用重结晶法 |
| C.萃取是利用溶质 在两种互不相溶的溶剂中溶解度的不同,使溶质从一种溶剂内转移到另一种溶剂的操作 。 |
| D.常用质谱法进行有机物相对分子质量的测定 |
有机物CH3—CH===CH—Cl不能发生的反应有( )
①取代反应 ②加成反应 ③消去反应 ④使溴水褪色 ⑤使KMnO4酸性溶液褪色 ⑥与AgNO3溶液生成白色沉淀 ⑦聚合反应
| A.①②③④⑤⑥⑦ | B.⑦ |
| C.⑥ | D.② |
某化工厂生产的某产品只含C、H、O三种元素,其分子模型如图所示(图中球与球之间的连线代表化学键,如单键、双键等)。下列物质中与该产品互为同分异构体的是( )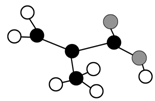
A.CH2===C(CH3)COOH
B.CH2===CHCOOCH3
C.CH3CH2CH===CHCOOH
D.CH3CH(CH3)COOH