干电池原理示意图如下,电池总反应为:Zn+2NH4+=Zn2++2NH3↑+H2↑,下列说法正确的是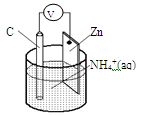
| A.碳为电池的正极 |
| B.Zn极上发生还原反应 |
| C.Zn2+移向该电池的负极 |
| D.反应2NH4++2e-=2NH3↑+H2↑在负极上发生 |
向含0.2molAlCl3的溶液中加入了一定量的1mol/L的NaOH溶液后,生成了7.8克的沉淀,则加入的NaOH溶液的体积为()
| A.100ml | B.200ml | C.300ml | D.400ml |
被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水反应,有如下反应NaBH4+2H2O=NaBO2+4H2↑,下列有关该反应的说法中,正确的是()
| A.NaBH4既是氧化剂又是还原剂 | B.NaBH4是氧化剂,H2O是还原剂 |
| C.硼元素被氧化,氢元素被还原 | D.被氧化的元素与被还原的元素质量比为1∶1 |
在某无色溶液中缓慢地滴入NaOH溶液直至过量,产生沉淀的质量与加入的NaOH溶液体积的关系如图所示,由此确定,原溶液中含有的阳离子是()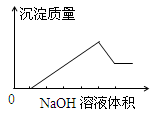
| A.Mg2+、Al3+、Fe2+ | B.H+、Mg2+、Al3+ |
| C.H+、Ba2+、Al3+ | D.只有Mg2+、Al3+ |
下列离子方程式书写正确的是()
| A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl- |
| B.金属钠和水的反应:Na+2H2O = H2↑+Na++2OH- |
| C.Al(OH) 3沉淀中滴加盐酸:Al(OH) 3+3H+= Al3++3H2O |
D.AlCl3溶液中加入过量氨水:Al3++4OH-=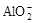 +2H2O +2H2O |
在酸性溶液中,能大量共存的离子是()
| A.Mg2+、Fe3+、NO3-、SCN- | B.Al3+、Fe2+、Cl-、NO3- |
| C.K+、 Na+、 Cl-、 HCO3- | D.Na+、Ba2+、NO3-、SO42- |