有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取。纯净的A为无色黏稠液体,易溶于水。为研究A的组成与结构,进行了如下实验:
(1)称取A 9.0 g,升温使其汽化,测其密度是相同条件下H2的45倍。
实验结论:A的相对分子质量为 。
(2)将此9.0 g A在足量纯O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重5.4 g和13.2 g。则A的分子式为 。
(3)另取A 9.0 g,跟足量的NaHCO3粉末反应,生成2.24 L CO2(标准状况),若与足量金属钠反应则生成2.24 L H2(标准状况)。
实验结论:A中含有的官能团: 、________。
(4)A的核磁共振氢谱如图: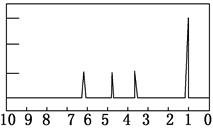
实验结论:A中含有 种氢原子。
(5)综上所述,A的结构简式_________________。
(16分) 乙酸苯乙酯是一种具有玫瑰花香,并带有可可香韵的有机物,常用于调配玫瑰、橙花、紫罗兰、晚香玉、野蔷薇等香精。天然乙酸苯乙酯存在于白兰花油和玫瑰花油中,也可通过化学方法合成。下图是一种合成路线(部分反应物和条件省略)。
已知A是一种不饱和烃,B、C、D都为含碳原子数相同的常见有机物。请回答:
(1)乙酸苯乙酯(H)的分子式为,F的结构简式为___________________;
(2)A→B属于反应,F→G属于反应;
(3)对图中有关化合物的叙述中正确的是;(填序号)
①化合物C不能发生银镜反应②化合物G属于醇类
③E、F、G都属于芳香烃④化合物D所含官能团为羧基
(4)写出D + G → H 的化学方程式:
(5)M是H的一种同系物,取1mol M完全燃烧可消耗9 mol O2,试写出苯环上只有一个支链的M的所有同分异构体的结构简式:
、、。
北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
⑴丙烷脱氢可得丙烯。
已知:①C3H8(g) = CH4(g)+HC≡CH(g)+H2(g);△H1=156.6kJ·mol-1
②CH3CH=CH2(g) = CH4(g)+HC≡CH(g) ;△H2=32.4kJ·mol-1
则相同条件下,反应C3H8(g) = CH3CH=CH2 (g)+H2(g)的△H=kJ·mol-1。
⑵以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为。
⑶碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3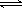 HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=。(已知:10-5.60=2.5×10-6)
⑷常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3)c(CO32-)(填“>”、“=”或“<”)。
.现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层电子数比K层电子数多4个 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T位于元素周期表的第______周期第_____族。写出T2-的原子结构示意图______________。
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式
。
(3)元素Z与元素T相比,非金属性较强的是(用元素符号表示),下列表述中能证明这一事实的是。
a常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是(填化学式)。
SO2和CO2均可使澄清石灰水变浑浊,现将混合气体SO2和CO2依次通过①品红;②酸性高锰酸钾;③品红;④澄清石灰水;请写出对应序号的现象和作用;
①品红;现象;作用;
②酸性高锰酸钾;现象;作用;
③品红;现象;作用;
④澄清石灰水;现象;作用;
键能的大小可以衡量化学键的强弱,也可以用于估算化学反应的反应热(△H),化学反应的△H等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。参考以下表格的键能数据,回答下列问题:
| 化学键 |
Si—O |
Si—Cl |
H—H |
H—Cl |
Si—Si |
Si—C |
| 键能/kJ·mol-1 |
460 |
360 |
436 |
431 |
176 |
347 |
(1)比较下列两组物质的熔点高低(填“>”或“<”)
SiC__________Si; SiCl4___________SiO2
(2)能不能根据键能的数据判断单质Si 和化合物SiCl4的熔点高低?____________(填“能”或“不能”),理由是___________________(提示对比二者晶体类型及内部微粒作用力)
(3)如右图立方体中心的“·”表示金刚石晶体中的一个原子,请在立方体的顶点用“·”表示出与之紧邻的碳原子;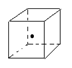
(4)工业上高纯硅可通过下列反应制取:
SiCl4(g) + 2H2(g)高温Si(s)+4HCl(g)
计算该反应的反应热△H为______________________(要包含数据和焓变单位)