硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3、MgO、CaO等,生产工艺流程示意图如下:
(1)将菱锌矿研磨成粉的目的是______________________ __。
(2)完成“氧化除铁”步骤中反应的离子方程式:
(3)针铁矿(Coethite)是以德国诗人歌德(Coethe)名字命名的,组成元素是Fe、O和H,化学式量为89,化学式是__________。
(4)根据下表数据,调节“滤液 2”的pH时,理论上可选用的最大区间为________________。
| |
Mg(OH)2 |
Zn(OH)2 |
MgCO3 |
CaCO3 |
| 开始沉淀的pH |
10.4 |
6.4 |
- |
- |
| 沉淀完全的pH |
12.4 |
8.0 |
- |
- |
| 开始溶解的pH |
- |
10.5 |
- |
- |
| Ksp |
5.6×10-12 |
- |
6.8×10-6 |
2.8×10-9 |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是________(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.烧碱溶液
(6)“滤液4”之后的操作依次为__________、__________、过滤、洗涤、干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于___________________。
如下图所示,是实验室制备某常见气体的实验装置,请填空:
(1) 该实验装置制备的常见气体是(填写化学式):。
(2) 制备该气体的化学方程式是:。
(3) 收集该气体的方法是:。
(4) 检验该气体是否收集满的方法是:
。
(5) 将充满该气体的试管倒立于水槽中,可以看到的现象是:
。
某化学实验小组的同学为了探究SO2和氯水的漂白性,设计如下实验装置。
(1)C装置的作用:______________________________。
(2)实验室用装置E制备Cl2,化学反应方程式为:MnO2+4HCl(浓) MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
MnCl2+Cl2↑+2H2O。该反应中的还原剂是____________(填化学式)。
(3)①反应开始一段时间后,观察到B、D两个试管中的品红溶液出现的现象是:
B_________________________, D________________________。
②停止通气后,再给B、D两个试管分别加热,两个试管中的现象分别为
B_________________________, D________________________。
(4)另一个实验小组的同学认为SO2和氯水都有漂白性,二者混合后漂白性肯定会增强。他们将制得的SO2和Cl2按1:1同时通入到品红溶液中,结果发现品红溶液未退色。请你分析产生该现象的原因_____________________________(用化学方程式表示)。
含镁3%-5%的镁铝合金,现已成为轮船制造、化工生产、机械制造等行业的重要原材料。现有一块已知质量为 g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
g的镁铝合金,欲测定其中镁的质量分数,几位同学设计了以下三种不同的实验方案:
实验设计1:镁铝合金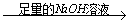 充分反应后测定剩余固体质量
充分反应后测定剩余固体质量 g
g
实验设计2:镁铝合金 生成的气体在标准状况下的体积为VL。
生成的气体在标准状况下的体积为VL。
请回答以下问题:
实验设计1:
(1)镁的质量分数:。
(2)在溶解、过滤中使用的玻璃仪器有 __________。
(3)过滤后洗涤沉淀的操作方法是________________________________________
____________________________________________________。
(4)如果过滤得到沉淀没有用蒸馏水洗涤数次后,烘干,再测定剩余固体质量。测得镁的质量分数量会(填“偏大”、“偏小”或“无影响”)。
实验室制取的乙烯常含有少量二氧化硫,现设计如下实验,确认混合气体中有乙烯和二氧化硫。
(1)a、b、c、d装置可盛放的试剂是:a________,b______,c_____,d______。
| A.品红溶液 | B.NaOH溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
(2)确定含有乙烯的现象是_________________________________________________。
给你提供纯锌、纯铜片和500mL0.2mol·L-1的H2SO4溶液、导线、1000mL量筒。试用下图装置来测定锌和稀硫酸反应时在某段时间内通过导线的电子的物质的量。
(1)如图所示,装置气密性良好,且1000mL量筒中已充满了水,则开始实验时,首先要______。
(2)a电极的反应式为_______。
b电极的反应式为_________。
(3)如果将a、b两电极的电极材料对调,U形管中将出现的现象是_________________