选做(12分)【化学——物质结构与性质】X、Y、Z为前四周期元素,且原子序数依次增大。X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子。请回答下列问题:
(1)X所在周期中第一电离能最大的主族元素是_______(填元素符号);H2X2分子中X原子的杂化方式是_______。
(2)Y与X可形成YX42-。
①YX42-的立体构型是_____________。
②写出一种与YX42-互为等电子体分子的化学式__________。
(3)Z的氯化物与氨水反应可形成配合物[Z(NH3)4]Cl2,1 mol该配合物中含有σ键的数目为_________。
(4)Y与Z形成化合物晶体的晶胞如图所示。已知该晶体的密度为a g·cm-3,则该晶胞的体积为___________cm3(NA表示阿伏加德罗常数的值)。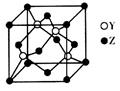
NO分子因污染空气而臭名昭著。近年来,发现少量的NO在生物体内许多组织中存在,它有扩张血管,增强免疫和记忆的功能,而成为当前生命科学的研究热点,NO亦被称为“明星分子”。请回答下列问题。
(1)NO对环境的危害在于
| A.破坏臭氧层 | B.高温下能使一些金属氧化 |
| C.造成酸雨 | D.与人体血红蛋白结合 |
(2)在含Cu+ 离子的酶的活化中心中,亚硝酸根离子可转化为NO,写出Cu+ 和亚硝酸根离子在酸性水溶液中反应的离子方程式:___________________
2015年某市决定开工建设垃圾焚烧发电厂,以改善目前填埋方式处理垃圾对环境产生的不良影响。其建成后既能利用垃圾,也能利用前期填埋垃圾产生的沼气,作为焚烧的原料。
(1)你认为这样做的好处是___________________。(至少答两点)
(2)前期填埋的垃圾中易腐败的有机物在一定条件下被细菌分解为沼气,沼气的成分是______(填名称)。写出沼气燃烧的化学方程式:。
汽车尾气(含有烃类、CO、SO2与NO等物质)是城市空气的污染物,治理的方法之一是在汽车的排气管上装上“催化转换器”(用钯、铂合金作催化剂)。它的特点是使CO与NO反应,生成可参与大气生态环境循环的无毒气体,并促使烃类充分燃烧及SO2的转化。
(1)写出CO与NO反应的化学方程式_________________________。
(2)“催化转换器”的缺点是在一定程度上提高了空气的酸度。其原因是______________________________________________________。
(3)控制城市污染源的方法可以有___________________。
小玲到了傍晚时就看不见东西,患了夜盲症。可能的原因之一是她的体内缺乏维生素;小可同学近期感到精神不振、疲劳、头晕、面色苍白,医生说她患了贫血病,此时她应该多补充蛋白质和含__________丰富的无机盐。
(1)工业废水中常含有Cu2+等重金属离子,直接排放会造成污染,目前在工业废水处理过程中,依据沉淀转化的原理,常用FeS等难溶物质作为沉淀剂除去这些离子。已知室温下Ksp(FeS)=6.3×10-18,Ksp(CuS)=1.3×10-36。请用离子方程式说明上述除杂的原理____________。
(2)工业上为了处理含有Cr2O72-的酸性工业废水, 用绿矾(FeSO4·7H2O)把废水中的六价铬离子还原成三价铬离子,再加入过量的石灰水,使铬离子转变为Cr(OH)3沉淀。
①氧化还原过程的离子方程式为_________________________________。
②常温下,Cr(OH)3的溶度积Ksp =1×10—32,溶液的pH至少为,才能使Cr3+沉淀完全。
③现用上述方法处理100m3含铬(+6价)78mg•L—1的废水,需用绿矾的质量为kg。(写出计算过程,保留到小数点后一位)