已知:(1)CH3COOH(l)+2O2(g)=2CO2(g)+2H2O(l) △H1
(2)C(s)+O2(g)=CO2(g) △H2
(3)2H2(g)+O2(g)=2H2O(l) △H3
(4)2CO2(g)+4H2(g)=CH3COOH(l)+2H2O(l) △H4
(5)2C(s)+2H2(g)+O2(g)=CH3COOH(l) △H5
下列关于上述反应的焓变的判断正确的是
| A.△H1>0,△H2<0 | B.△H5=2△H2+△H3-△H1 |
| C.△H3>0,△H5<0 | D.△H4=△H1-2△H3 |
对处于化学平衡的体系,关于化学平衡与化学反应速率的关系正确的是
| A.化学反应速率变化时,化学平衡一定发生移动 |
| B.只有在催化剂存在下,才会发生化学反应速率变化,而化学平衡不移动的情况 |
| C.正反应进行的程度大,正反应速率一定大 |
| D.化学平衡发生移动时,化学反应速率一定变化 |
气体的自动化检测中常常应用原电池原理的传感器。下图为电池的工作示意图:气体扩散进入传感器,在敏感电极上发生反应,传感器就会接收到电信号。下表列出了待测气体及敏感电极上部分反应产物。则下列说法中正确的是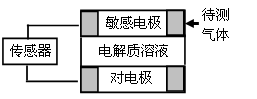
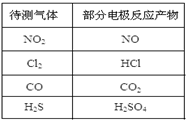
| A.上述气体检测时,敏感电极均作电池正极 |
| B.检测Cl2时,敏感电极的电极反应式为:Cl2 + 2e-= 2Cl- |
| C.检测H2S时,对电极充入空气,对电极上的电极反应式为O2 + 2H2O+ 4e- = 4OH- |
| D.检测分别含H2S和CO体积分数相同的两份空气样本时,传感器上产生的电流大小相同 |
观察下列几个装置示意图,有关叙述正确的是
| 选项 |
装置 |
叙述 |
| A |
 |
装置①中阳极上析出红色固体 |
| B |
 |
装置②的待镀铁制品应与电源正极相连 |
| C |
 |
装置③中外电路电子由a极流向b极 |
| D |
 |
装置④中的离子交换膜允许阳离子、阴离子、水分子自由通过 |
下列有关电化学的内容正确的是
| A.马口铁和白铁皮破损后,白铁皮比马口铁腐蚀快,所以使用白铁皮时要注意防止铁皮出现刮痕 |
| B.原电池中电子从负极流出流入正极,电解池中电子从阴极流出流入电源负极 |
C.已知磷酸亚铁锂电池总反应为FePO4 + Li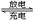 LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4+e-=FePO4+Li+ LiFePO4,电池中的固体电解质可传导Li+,则该电池充电时阳极电极反应式为:LiFePO4+e-=FePO4+Li+ |
| D.常温下以C选项中电池为电源以石墨为电极电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为14(忽略溶液的体积变化) |
能正确表示下列反应的离子方程式是
| A.钠与CuSO4溶液反应:2Na+Cu2+=Cu↓+2Na+ |
| B.Na2S2O3溶液中加入稀硫酸:2S2O32-+4H+=SO42-+3S↓+2H2O |
C.用铜做电极电解CuSO4溶液:2Cu2++2H2O 2Cu+O2↑+4H+ 2Cu+O2↑+4H+ |
| D.向FeCl3溶液中加入Mg(OH)2:3Mg(OH)2+2Fe3+=2Fe(OH)3+3Mg2+ |