X、Y、Z、W是原子序数依次增大的四种短周期元素,甲、乙、丙、丁、戊是由其中的两种或三种元素组成的化合物,己是由Z元素形成的单质。已知:甲 + 乙 = 丁 + 己,甲 + 丙 = 戊 + 己;0.1 mol·L-1丁溶液的pH为13(25℃)。下列说法正确的是
| A.1 mol甲与足量的乙完全反应共转移了1 mol电子 |
| B.Y元素在周期表中的位置为第三周期第ⅣA族 |
| C.原子半径:W>Z>Y>X |
| D.1.0 L 0.1 mol·L-1戊溶液中阴离子总的物质的量小于0.1 mol |
某温度下, 在固定体积的密闭容器中, 可逆反应 A(气) + 3B(气)  2C(气) 达到平衡时, 各物质的物质的量之比为A:B:C = 2:2:1,保持温度不变,以2:2:1的物质的量之比再次充入A、B、C,则
2C(气) 达到平衡时, 各物质的物质的量之比为A:B:C = 2:2:1,保持温度不变,以2:2:1的物质的量之比再次充入A、B、C,则
A、平衡逆向移动 B、平衡时A的体积分数增大
C、平衡时C的体积分数增大 D、平衡时各气体的体积分数不变
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是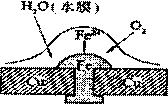
| A.负极电极反应式为:Fe-3e-=Fe3+ |
| B.此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3 |
| C.此过程中铜并不被腐蚀 |
| D.此过程中电子从Fe移向Cu |
市场上经常见到的标记为Li-ion的电池称为“锂离子电池”。它的负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应为: Li+2Li
Li+2Li
 下列说法不正确的是
下列说法不正确的是
A.放电时,负极的电极反应式:Li-e-=Li+ |
B.充电时,Li0.85NiO2既发生氧化反应又发生还原反应 |
C.该电池不能用水溶液作为电解质 |
D.放电过程中Li+向负极移动 |
一定温度下,可逆反应A2(s)+3B2(g)  2AB3(g)在可变容器中不能作为达到平衡的标志是
2AB3(g)在可变容器中不能作为达到平衡的标志是
| A.容器内每减少1mol A2,同时消耗2mol AB3 |
| B.容器内nA2:nB2:nAB3=1:3:2 |
| C.混合气体总的物质的量 |
| D.容器内的气体密度不再改变 |
下列事实不能用勒夏特利原理来解释的是
| A.光照新制的氯水时,溶液中的pH值逐渐减少 |
| B.加催化剂使N2和H2在一定条件下转化为NH3 |
| C.增大压强,有利于SO2和O2反应生成SO3 |
D.在Fe3++3SCN- Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 Fe(SCN)3反应达平衡时,增加KSCN的浓度,体系颜色变深 |