某校化学研究性学习小组的同学在学习了氨的性质后讨论:运用类比的思想,既然
氨气具有还原性,氨气能否象H2那样还原CuO呢?他们设计实验制取氨气并探究上述问题。请你参与该小组的活动并完成下列研究:
(一)制取氨气
(1)实验室用装置A可快速制取氨气,写出反应的化学方程式 。
(二)实验探究
该小组成员设计实验探究氨气还原性及其产物,实验装置(夹持及尾气处理装置未画出)图如下:
(2)该装置在设计上有一定的缺陷,为确保实验结果的准确性,你对该装置的改进措施是 。
(3)利用改进后的装置进行实验,观察到CuO变为红色物质,无水CuSO4变蓝,同时生成一种无污染的气体。请写出NH3与CuO反应的化学方程式 。
(三)问题讨论
(4)有同学认为:NH3与CuO反应生成的红色物质中可能含有Cu2O。已知Cu2O是红色粉末,在酸性溶液中,Cu+能自身发生氧化还原反应生成Cu2+和Cu。请你设计一个简单的实验检验该红色物质中是否含有Cu2O: 。
(5)在解决了问题(1)后,又有同学提出:Cu2O与CuO的热稳定性哪个更强?于是他们进行了如下实验:取98 g Cu(OH)2固体,加热到80℃~100℃时,得到黑色固体粉未,继续加热到1000℃以上,黑色粉未全部变成红色粉未A。冷却后称量,A的质量为72 g。
据此可推得A为 ,请写出上述过程中发生反应的两个化学方程式 ,由此得到的结论是 。
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。从废料中回收氧化钴(CoO)的工艺流程如下: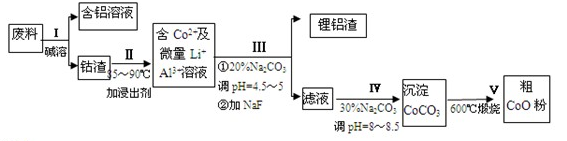
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_____ ___。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__ __。
(5)在Na2CO3溶液中存在多种离子,各种离子的浓度由大到小顺序为_ 。
(6)CoO溶于盐酸可得粉红色的CoCl2溶液。CoCl2含结晶水数目不同而呈现不同颜色,利用蓝色的无水CoCl2吸水变色这一性质可制成变色水泥和显隐墨水。下图是粉红色的CoCl2·6H2O晶体受热分解时,剩余固体质量随温度变化的曲线,B物质的化学式是___ ___。
铁矿石是工业炼铁的主要原料之一,其主要成分为铁的氧化物(设杂质中不含铁元素和氧元素,且杂质不与H2SO4反应)。某研究性学习小组对某铁矿石中铁的氧化物的化学式进行探究。
Ⅰ.铁矿石中含氧量的测定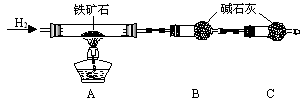
① 按上图组装仪器,检查装置的气密性;
② 将5.0g铁矿石放入硬质玻璃管中,装置B、C中的药品如图所示(夹持仪器均省略);
③ 从左端导气管口处不断地缓缓通入H2,待C装置出口处H2验纯后,点燃A处酒精灯;
④ 充分反应后,撤掉酒精灯,再持续通入氢气至完全冷却。
(1)装置C的作用为 。
(2)若将H2换成CO,则还需补充 装置。
(3)测的反应后装置B增重1.35g,则铁矿石中氧的百分含量为 。
Ⅱ.铁矿石中含铁量的测定
(1)步骤④中煮沸的作用是 。
(2)步骤⑤中用到的玻璃仪器有烧杯、玻璃棒、胶头滴管、 。
(3)下列有关步骤⑥的操作中说法正确的是 。
a.因为碘水为黄色,所以滴定过程中不需加指示剂
b.滴定过程中可利用淀粉溶液作为指示剂
c.滴定管用蒸馏水洗涤后可以直接装液
d.锥形瓶不需要用待测夜润洗
e.滴定过程中,眼睛注视滴定管中液面变化
f.滴定结束后,30s内溶液不恢复原来的颜色,再读数
(4)若滴定过程中消耗0.5000mol·L−1的KI溶液20.00mL,则铁矿石中铁的百分含量为 。
Ⅲ.由Ⅰ、Ⅱ可以推算出该铁矿石中铁的氧化物的化学式为 。
硫酸工业产生的废气A(主要成分:SO2、O2、N2、CO2等)排放到空气中会污染环境。某化学兴趣小组对废气A的组成进行探究,请回答下列问题。
(1)同学甲设计实验检验废气A中含有的CO2,应选择的试剂有 。
| A.NaOH溶液 | B.酸性KMnO4溶液 | C.澄清石灰水 | D.盐酸 |
(2)同学乙欲测定废气A中SO2的含量,取a L废气A并设计了如下装置进行实验。
①为了保证实验成功,装置A应具有的现象是 ,搅拌的目的是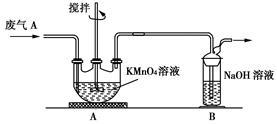
②同学丙认为A装置前后的质量差就是a L废气中含有的SO2的质量,然后进行含量计算。经小组讨论后,同学丁提出疑问,按照同学丙的实验,若废气中SO2完全被吸收,则最后测定的结果应该偏大,同学丁推断的理由是 。
(3)兴趣小组的同学查阅资料发现可利用硫酸工业废气A制备皓矾(ZnSO4•7H2O)。实验模拟制备皓矾工业流程如下: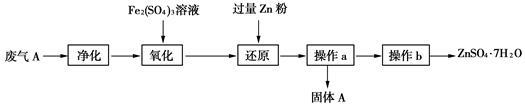
①“氧化”中加入硫酸铁发生反应的离子方程式是 。
②加入Zn粉的目的是 。
③固体A主要成分是 。
④操作b得到纯净皓矾晶体,必要的操作是 、过滤、洗涤、干燥。
铁钾矾[KxFey(SO4)m·nH2O]常用作工业媒染剂。其组成可用如下方法测定:
①准确称取2.0120g样品配成100mL溶液A。
②准确量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.466g。
③准确量取25.00mL溶液A,加入足量的KI溶液,以淀粉为指示剂,用0.1250 mol·L-1的Na2S2O3溶液滴定,消耗8.00mL至终点(已知:I2+2Na2S2O3=2NaI+Na2S4O6)。
(1)要检验出A溶液中存在的Fe3+,可以加入 溶液。
(2)已知室温下BaSO4的Ksp=1.1×10-10,欲使溶液中c(SO42-)≤1.0×10-5 mol•L-1,应保持溶液中c(Ba2+)≥ mol·L-1。
(3)步骤③中判断滴定终点的方法是 。
(4)通过计算确定铁钾矾的组成(写出计算过程)。
钛酸钡粉体是电子陶瓷元器件的重要基础原料。工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。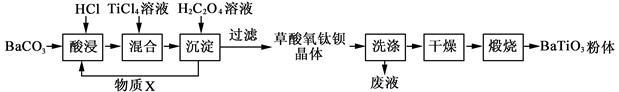
(1)酸浸时发生的反应的离子方程式为 ;为提高BaCO3的酸浸率,可采取的措施为 (任答一点)。
(2)配制TiCl4溶液时,通常将TiCl4溶于浓盐酸,目的是 。
(3)加入H2C2O4溶液时,发生反应的化学方程式 ;可循环使用的物质X是 。
(4)煅烧得到BaTiO3的同时,生成高温下的气体产物有CO、 和 。