减少二氧化碳的排放,氮氧化物、二氧化硫的处理与利用是一项重要的热点课题。
Ⅰ.(1)CO2经催化加氢可合成低碳烯烃:2CO2(g) + 6H2(g) C2H4(g) + 4H2O(g)
C2H4(g) + 4H2O(g) 
在0.1 MPa时,按 =1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
=1:3投料,图1所示不同温度(T)下,平衡时的四种气态物质的物质的量(n)的关系。
①该反应的△H__________0(填“>”、“=”或“<”)。
②曲线b表示的物质为__________。
③为提高CO2的平衡转化率,除改变温度外,还可采取的措施是__________。
(2)在强酸性的电解质水溶液中,惰性材料做电极,电解CO2可得到多种燃料,其原理如图2所示。
b为电源的__________极,电解时,生成乙烯的电极反应式是 。
Ⅱ.(3)用活性炭还原法可以处理氮氧化物。
如反应:C(s)+2NO(g) N2(g)+CO2(g) △H=Q kJ·mol-1。
N2(g)+CO2(g) △H=Q kJ·mol-1。
在T1℃时,反应进行到不同时间测得各物质的浓度如下:
①Tl℃时,该反应的平衡常数K= 。
②30 min后,只改变某一条件,反应重新达到平衡,根据上表中的数据判断改变的条件可能是_______(答一种即可)。
Ⅲ.(4)工业上可以用NaOH溶液或氨水吸收过量的SO2,分别生成NaHSO3、NH4HSO3,其水溶液均呈酸性。相同条件下,同浓度的两种酸式盐的水溶液中c(SO32-)较小的是 ,用文字和化学用语解释原因 。
在含有弱电解质的溶液中,往往有多个化学平衡共存。
(1)一定温度下,向1 L 0.1 mol·L-1CH3COOH溶液中加入0.1 mol CH3COONa固体,溶液中 (填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(填“增大”、“减小”或“不变”);写出表示该混合溶液中所有离子浓度之间的一个等式。
(2)土壤的pH一般在4~9之间。土壤中Na2CO3含量较高时,pH可以高达10.5,试用离子方程式解释土壤呈碱性的原因。加入石膏(CaSO4·2H2O)可以使土壤碱性降低,有关反应的化学方程式为。
(3)常温下向20 mL 0.1 mol·L-1Na2CO3溶液中逐滴加入0.1 mol·L-1HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数随溶液pH变化的情况如下:
回答下列问题:
①在同一溶液中,H2CO3、HCO3-、CO32-(填“能”或“不能”)大量共存;
②当pH=7时,溶液中含碳元素的主要微粒有、,溶液中含量最多的三种微粒的物质的量浓度的大小关系为;
(14分)甲醇是一种重要的化工原料,在生产中有着重要的应用。工业上用甲烷氧化法合成甲醇的反应有: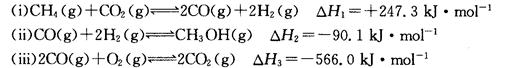
(1)用CH4和02直接制备甲醇蒸气的热化学方程式为。
(2)某温度下,向4 L恒容密闭容器中通人6 mol C02和6mol CH4,发生反应(i),平衡体系中各组分的体积分数均为 ,则此温度下该反应的平衡常数K=,CH4的转化率为。
,则此温度下该反应的平衡常数K=,CH4的转化率为。
(3)工业上可通过甲醇羰基化法制取甲酸甲酯,其反应的热化学方程式为: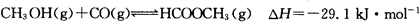 ,科研人员对该反应进行了研究,部分研究结果如下:
,科研人员对该反应进行了研究,部分研究结果如下: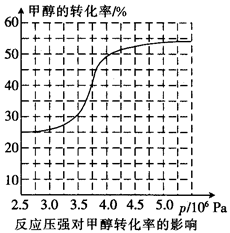
①从反应压强对甲醇转化率的影响“效率”看,工业制取甲酸甲酯应选择的压强是(填“3.5× 106 Pa” “4.O×106 Pa”或“5.0× 106 Pa”)。
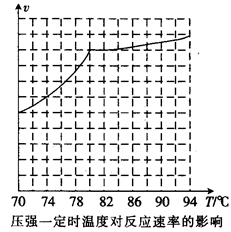
②实际工业生产中采用的温度是80℃,其理由是。
(4)直接甲醇燃料电池(简称DMFC)由于其结构简单、能量转化率高、对环境无污染,可作为常规能源的替代品而越来越受到关注。DMFC的工作原理如图所示: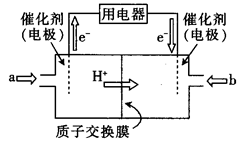
①通入a气体的电极是电池的(填“正”或“负”)极,其电极反应式为 .
②常温下,用此电池以惰性电极电解O.5 L饱和食盐水(足量),若两极共生成气体1.12 L(已折算为标准状况下的体积),则电解后溶液的pH为(忽略溶液的体积变化)。
用辉铜矿(主要成分为Cu2S,含少量Fe2O3、SiO2等杂质)制备难溶于水的碱式碳酸铜的流程如下:
(1)下列措施是为加快浸取速率,无法达到目的的是____
| A.延长浸取时间 | B.将辉铜矿粉碎 |
| C.充分搅拌 | D.适当增加硫酸浓度 |
(2)浸取反应中氧化剂的化学式为;滤渣Ⅰ的成分为MnO2、S和(写化学式);
(3)研究发现,若先除铁再浸取,浸取速率明显变慢,可能的原因是。
(4)“除铁”的方法是通过调节溶液PH,使Fe3+水解转化为Fe(OH)3,加入的试剂A可以是_____(化学式);“赶氨”时,最适宜的操作方法。
(5)“沉锰”(除Mn2+)过程中反应的离子方程式__________________________。
(6)滤液Ⅱ经蒸发结晶得到的盐主要是(写化学式)。
(14分)下表为元素周期表的一部分:(用元素符号或化学式填空)
| 族 周期 |
||||||||
| ① |
||||||||
| ② |
||||||||
| ③ |
④ |
⑤ |
⑥ |
(1)写出元素④在周期表中的位置______________。
(2)②、③、⑤的原子半径由大到小的顺序为_________________________。
(3)④、⑤、⑥的气态氢化物的稳定性由强到弱的顺序是_________________________。
(4)①、②、③、⑥中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:____________________。
Ⅱ.由上述部分元素组成的物质间,在一定条件下,可以发生下图所示的变化,其中A是一种淡黄色固体。请回答: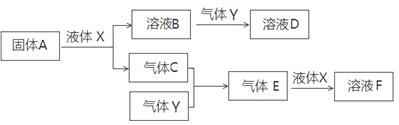
(1)写出固体A与液体X反应的离子方程式。
(2)气体Y是一种大气污染物,直接排放会形成酸雨。可用溶液B吸收,当B与Y物质的量之比为1:1且恰好完全反应时,所得溶液D的溶质为(填化学式)。
(3)写出气体C与气体Y反应的化学方程式。
[化学——选修3:物质结构与性质]
已知A、B、C、D四种短周期元素,它们的核电荷数依次增大。A原子,C原子的L能层中,都有两个未成对的电子,C、D同主族。E、F都是第四周期元素,E原子核外有4个未成对电子,F原子除最外能层只有1个电子外,其余各能层均为全充满。根据以上信息填空:
(1)基态D原子中,电子占据的最高能层符号,该能层具有的原子轨道数为;
(2)E2+离子的价层电子轨道表示式是,F原子的电子排布式是;
(3)A元素的最高价氧化物对应的水化物中心原子采取的轨道杂化方式为,B元素的气态氢化物的分子模型为;
(4)化合物AC2、B2C和阴离子DAB-互为等电子体,它们结构相似,DAB-的电子式为;
(5)配合物甲的焰色反应呈紫色,其内界由中心离子E3+与配位体AB-构成,配位数为6,甲的水溶液可以用于实验室中E2+离子的定性检验,检验E2+离子的离子方程式为;
(6)某种化合物由D,E,F三种元素组成,其晶胞如图所示,则其化学式为,该晶胞上下底面为正方形,侧面与底面垂直,根据图中所示的数据列式计算该晶体的密度:d=g/cm3。