(15分)元素周期表第ⅤA族元素包括氮、磷、砷(As)、锑(Sb)等。这些元素无论在研制新型材料,还是在制作传统化肥、农药等方面都发挥了重要的作用。请回答下列问题:
(1)N4分子是一种不稳定的多氮分子,这种物质分解后能产生无毒的氮气并释放出大量能量,能被应用于制造推进剂或炸药。N4是由四个氮原子组成的氮单质,其中氮原子采用的轨道杂化方式为sp3,该分子的空间构型为________,N—N键的键角为________。
(2)基态砷原子的最外层电子排布式为________。
(3)N、P、As原子的第一电离能由大到小的顺序为____________(用元素符号表示)。
(4)叠氮化钠(NaN3)用于汽车安全气囊中氮气的发生剂,写出与N3-互为等电子体的分子的化学式________(任写一种即可)。
(5)天然氨基酸的命名常用俗名(根据来源与性质),例如,最初从蚕丝中得到的氨基酸叫丝氨酸[HOCH2CH(NH2)COOH]。判断丝氨酸是否存在手性异构体?________(填“是”或“否”)
(6)砷化镓为第三代半导体,以其为材料制造的灯泡寿命长,耗能少。已知立方砷化镓晶胞的结构如图所示,其晶胞边长为c pm,则密度为_______g·cm-3(用含c的式子表示,设NA为阿伏加德罗常数的值),a位置As原子与b位置As原子之间的距离为________pm(用含c的式子表示)。
(14分,每空2分)
I.在1L容器中通入CO2、H2各2mol,在一定条件下发生反应:CO2 + H2 CO + H2O,
CO + H2O,
回答下列问题:
(1)在830℃条件下,反应达到平衡时CO2的转化率为50%。求该条件下平衡常数K1=________。
(2)在(1)的基础上,把体系温度降至800℃。已知该条件下的平衡常数K2=0.81,可以推知 该反应的正反应为___________反应(填“吸热”、“放热”)。
(3)在(1)的基础上,压缩容器体积之0.5 L。该条件下的平衡常数为K3。则K3________K1
L。该条件下的平衡常数为K3。则K3________K1
(4)T℃时,某时刻测得体系中各物质的量如下:n(CO2 )=1.2mol,n(H2)=1.5mol,
)=1.2mol,n(H2)=1.5mol,
n(CO)=0.9mol,n(H2O)=0.9mol,则此时该反应进行.
(填“向正反应方向”“向逆反应方向”或“处于平衡状态”)。
II.向一容积为1L 的密 闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)
闭容器中加入一定量的X、Y,发生化学反应X(g)+2Y(s)  2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。
2Z(g);△H<0。右图是容器中X、Z的物质的量浓度随时间变化的曲线。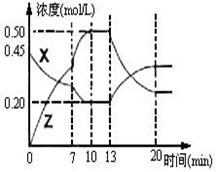
(1)0~10min 容器内气体的压强逐渐 ___________。
(填“变大”、“变小”或“无法确定”)
(2)推测在第7min时曲线变化的原因可能是 ___
第13min时曲线变化的原因可能是 __(填序号)
__(填序号)
①增加Z的量②增加X的量③升温
④降温⑤使用催化剂
(24分,每空3分)
(1)将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3 的浓度为0.6mol·L-1,请回答下列问题:
的浓度为0.6mol·L-1,请回答下列问题:
①用O2表示的反应的平均速率为___________________________ __________
__________
②平衡时SO2的转化率______________________________________
③平衡时SO3的体积分数为___________________________
④10s时O2的浓度为_____________________________________________
(2)已知某可逆反应mA(g)+nB(g)  qC(g)在密闭容器中进行。
qC(g)在密闭容器中进行。
如图所示反应在不同时间t,温度T和压强P与反应物B的体积
分数的关系曲线。根据图象填空
①化学计量数的关系:m+n______q;(填“ >”.“<”或“=”)
>”.“<”或“=”)
②该反应的正反应为___________反应。(填“吸热”或“放热”)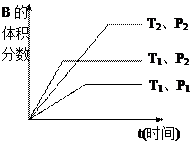
(3)在FeCl3+3KSCN Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
Fe(SCN)3+3KCl的平衡体系中,回答下列问题:
(填“正向”、“逆向”、“不”)
①在溶液中加入少量的KSCN固体,平衡 ______________移动。
②在溶液中加入少量的KCl固体, 平衡 _____________移动。
平衡 _____________移动。
某化学兴趣小组用含有铝、铁、铜的合金制取纯净的氯化铝溶液、绿矾晶体[FeSO4·7H2O]和胆矾晶体,以探索工业废料的再利用。其实验方案如下: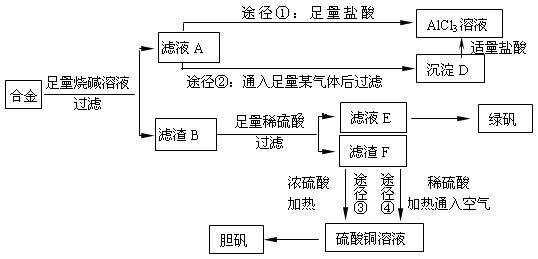
回答下列问题:
(1)写出合金与烧碱溶液反应的离子方程式。
(2)由滤液A制AlCl3溶液的途径有①和②两种,你认为合理的 是。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有和玻璃棒;其中玻璃棒的作用是。
是。上述实验方案多处采用了过滤操作,过滤所用到的玻璃仪器有和玻璃棒;其中玻璃棒的作用是。
(3)用滤渣F通过两种途径制取胆矾,与途径③相比,途径④明显具有的两个优点是、。
(4)通过途径 ④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、、冷却结晶、、自然干燥。其中“加热通氧气”所起的作用为(用离子方程式表示)。
④制取胆矾,必须进行的实验操作步骤:加硫酸、加热通氧气、过滤、、冷却结晶、、自然干燥。其中“加热通氧气”所起的作用为(用离子方程式表示)。 (5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===C
(5)测定所得胆矾(CuSO4·xH2O)中x值的实验方案是蒸发硫酸铜晶体中的水得到白色的无水硫酸铜,冷却后称量。此变化的化学方程式为:CuSO4·xH2O===C uSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行次。若测定结果x值偏高,可能的原因是。
uSO4+xH2O ,但温度过高,CuSO4会继续分解为CuO和SO3。在此实验过程中,称量操作至少进行次。若测定结果x值偏高,可能的原因是。
a.加热温度过高 b.加热时胆矾晶体飞溅出来
c.加热后放在空气中冷却 d.所用坩埚事先未干燥(潮湿)
实 验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。
验室中,用如下图所示装置及所给药品(图中部分夹持仪器已略去)探究工业制硫酸接触室中的反应,并测定此条件下二氧化硫的转化率。已知SO3熔点为16.8℃,假设气体进入装置时分别被完全吸收,且忽略装置内空气中的CO2。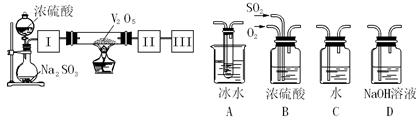
(1)已知0.5molSO2被O2氧化成气态SO3,放出49.15 kJ热量,反应的热化学方程式为。
(2)根据实验目的,请从上面右图中选择Ⅰ、Ⅱ、Ⅲ处合适的装置,将其序号填入空格中:装置Ⅰ,装置Ⅱ,装置Ⅲ。
(3)开始进行实验时,首先应进行的操作是。
(4)加热硬质玻璃管时,若不断升高温度,SO2的转化率会(填“增大”、“不变”或“减小”)。
(5)停止通入SO2,熄灭酒精灯后,为使残留在装置中的SO2、SO3被充分吸收,操作方法是。
(6)实验结束后,若装置Ⅱ增加的质量为b g ,装置Ⅲ增加的质量为a g,则此条件下二氧化硫的转化率是(用含字母的代数表示)。
原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于 同主族。
同主族。
(1)X元素符号是
(2)Z、W形成的气态氢化物的稳定性 > (写化学式)。
(3)由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 。
(4)由X、Y、Z、W四种元素组成的一种离子化合物A,已知①1mol A能与足量NaOH浓溶液反应生成标准状况下44.8L气体。②A能与盐酸反应产生气体,该气体能与氯水反应,写出该气体与氯水反应的离子方程式 。
。
(5)由X、Y、Z、W和Fe五种元素组成的 式量为392的化合物B,1
式量为392的化合物B,1  mol B中含有6mol结晶水。对化合物B进行如下实验:
mol B中含有6mol结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体;过
一段时间白色沉淀变为灰绿色,最终变为红褐色。
b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①由实验a 、b 推知B溶液中含有的离子为;
②B的化学式为 。