(1)氨在国民经济中占有重要地位。
工业合成氨的反应原理为:N2(g)+ 3H2(g) 2NH3(g) △H="―92.4" kJ·mol-1。
2NH3(g) △H="―92.4" kJ·mol-1。
①若起始时向容器内放入2mol N2和6mol H2,达平衡后放出的热量为Q,则Q 184.8 kJ(填“>”、“<”或“=”)。
②已知:
1mol N—H键断裂吸收的能量为 kJ。
③某温度下,把10 mol N2与28 mol H2置于容积为10 L的密闭容器内,10 min时反应达到平衡状态,测得氮气的平衡转化率为60%,则10 min内该反应的平均速率v(H2)= mol·L-1·min-1,该温度下反应的平衡常数K = 。欲增大氮气的平衡转化率,可采取的措施有 (写一种措施即可)。
(2)某课外小组用下图所示装置对电解原理进行实验探究。用下图所示装置进行实验。实验过程中,两极均有气体产生,Y极区产生氧气,同时Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清。查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色。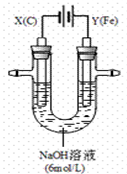
① 电解过程中,X极区溶液的pH (填“增大”、“减小”或“不变”)。
② 电解过程中,Y极发生的两个电极反应为Fe-6e-+8OH-="=" FeO42-+4H2O和 。
③ 若在X极收集到672 mL气体,在Y极收集到168 mL气体(均已折算为标准状况时气体体积),则Y电极(铁电极)质量减少 g。
④在碱性锌电池中,用高铁酸钾作为正极材料,电池反应为:2K2FeO4 + 3Zn ="=" Fe2O3 +ZnO +2K2ZnO2,该电池正极发生的反应的电极反应式为 。
某种优质燃油由甲、乙两种有机物混合而成,甲、乙两种物质含有C、H、O三种元素中的两种或三种。已知甲、乙及CO、H2的燃烧热如下:
| 物质 |
甲 |
乙 |
CO |
H2 |
| 燃烧热/kJ·mol-1 |
1 366 |
5 518 |
283 |
286 |
取甲、乙按不同比例混合的燃油23 g,在足量的O2中燃烧时,放出的热量Q与混合物中乙的物质的量分数x的关系如图所示。试求: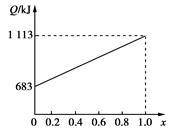
(1)乙的相对分子质量Mr(乙)=________。
(2)160 g由甲、乙以等物质的量混合而成的燃油在347.2 L O2中恰好完全燃烧,得492.8 L气体,冷却到室温时,还剩余224 L(气体体积均在标准状况下测定)。由此可求得混合物中,C、H、O的原子个数比为________。甲、乙的分子式:甲________;乙________。
(3)1 mol由甲、乙以等物质的量混合而成的燃油在一定量的O2中燃烧,放出热量2 876 kJ,则反应中生成CO________ mol。
①CaCO3(s)===CaO(s)+CO2(g) ΔH=-177.7 kJ/mol
②0.5H2SO4(l)+NaOH(l)==0.5Na2SO4(l)+H2O(l) ΔH=-57.3 kJ/mol
③C(s)+O2(g)===CO2(g)ΔH=-393.5 kJ/mol
④CO(g)+1/2O2(g)===CO2(g)ΔH=-283 kJ/mol
⑤HNO3(aq)+NaOH(aq)===NaNO3(aq)+H2O(l)ΔH=-57.3 kJ/mol
(1)上述热化学方程式中,不正确的有_____________ (填序号,以下同) 。
(2)上述反应中,表示燃烧热的热化学方程式是______________;上述反应中,表示中和热的热化学方程式是_________________。
(1)1 g碳与适量水蒸气反应生成CO和H2,需吸收10.94 kJ热量,此反应的热化学方程式为_____________。
(2)以H2为燃料可制成氢氧燃料电池。已知: 2H2(g)+O2(g)===2H2O(l) ΔH=-572 kJ·mol-1,某氢氧燃料电池释放228.8 kJ电能时,生成1 mol液态水,该电池的能量转化率为________。
红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如下图所示(图中的ΔH表示生成1 mol产物的数据)。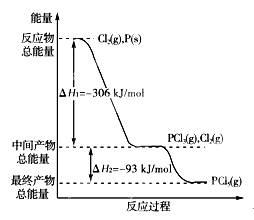
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是_____________;
(2)PCl5分解成PCl3和Cl2的热化学方程式是_______________。
上述分解反应是一个可逆反应,温度T1时,在密闭容器中加入0.80 mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率α1等于 ;
(3)P和Cl2分两步反应生成1 mol PCl5的反应热ΔH3= ,P和Cl2一步反应生成1 mol PCl5的ΔH4 ΔH3(填“大于”、“小于”或“等于”);
(4)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是____________________。
(1)家用液化气的主要成分之一是丁烷(C4H10),当1kg丁烷完全燃烧生成二氧化碳和液态水时,放出热量为5×104kJ,试写出表示丁烷燃烧热的热化学方程式 。
(2)科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热ΔH分别为-285.8 kJ/mol、-283.0 kJ/mol和-726.5 kJ/mol。请回答下列问题:
①用太阳能分解10 mol水消耗的能量是 kJ;
②甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式 ;
③研究NO2、SO2、CO等大气污染气体的处理具有重要意义,已知:
2SO2(g)+O2(g) = 2SO3(g) ΔH=-196.6 kJ/mol
2NO(g)+O2(g) = 2NO2(g) ΔH=-113.0 kJ/mol
则反应NO2(g)+SO2(g)=SO3(g)+NO(g)的ΔH= kJ/mol。
(3)盖斯定律在生产和科学研究中有很重要的意义.有些反应的反应热虽然无法直接测得,但可通过间接的方法测定.现根据下列3个热化学反应方程式:
Fe2O3(s)+3CO(g)═2Fe(s)+3CO2(g)△H=-24.8kJ•mol-1
3Fe2O3(s)+CO(g)═2Fe3O4(s)+CO2(g)△H=-47.4kJ•mol-1
Fe3O4(s)+CO(g)═3FeO(s)+CO2(g)△H=+640.5kJ•mol-1
写出CO(g)还原FeO(s)得到Fe(s)体和CO2(g)的热化学反应方程式 .