下列各组中的反应,属于同一反应类型的是

| A.乙烯水化制乙醇;溴乙烷水解制乙醇 |
| B.甲苯使酸性高锰酸钾溶液褪色;丙炔使溴的四氯化碳溶液褪色 |
| C.甲苯硝化制TNT;乙烯氧化制乙醛 |
D.  乙醇脱水制乙烯;溴乙烷消去制乙烯 乙醇脱水制乙烯;溴乙烷消去制乙烯 |
有机物的命名是有规则的,下列有机物命名正确的是()
| A.CH2=CH-CH=CH2 1,3—二丁烯 | B.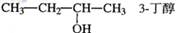 |
C.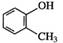 甲基苯酚 甲基苯酚 |
D.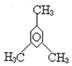 1,3,5—三甲基苯 1,3,5—三甲基苯 |
下列说法正确的是()
| A.煤的干馏、石油的分馏都是化学变化 |
| B.溶于汽油、酒精等有机溶剂中的物质一定是有机物 |
| C.除去试管内壁上的“银镜”,可用稀氨水洗涤 |
| D.淀粉和纤维素的组成都是(C6H10O5)n,水解最终产物都是葡萄糖 |
已知:Ni+CuSO4=NiSO4+Cu Cu+2AgNO3=Cu(NO3)2+2Ag则下列判断正确的是( )
| A.还原性:Ni>Cu>Ag | B.氧化性:Ni2+ >Cu2+ >Ag+ |
| C.还原性:Ni<Cu<Ag | D.氧化性:Ni2+ <Cu2+ <Ag+ |
下列离子方程式书写正确的是()
| A.FeCl2溶液中通入Cl2: Fe2++Cl2=Fe3++2Cl- |
| B.向澄清石灰水中通入少量CO2: Ca2++2OH-+CO2=CaCO3↓+H2O |
| C.FeS固体放入稀硝酸溶液中: FeS+2H+=Fe2++H2S↑ |
| D.AlCl3溶液中加入过量烧碱溶液:Al3++4OH-=AlO2—+2H2O |
下列关于钠及其化合物的叙述中错误的是()
| A.碳酸钠比碳酸氢钠的热稳定性要好 | B.钠在空气中燃烧生成Na2O |
| C.钠在发生化学反应时只作还原剂 | D.钠单质暴露在空气中最终将变成Na2CO3 |